石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如表:
| 稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加入5g |
| 剩余固体的质量 | 3g | 2g | 1g | 1g |
(1)计算该石灰石样品中碳酸钙的质量分数.
(2)计算该20g稀盐酸中含有HCl的质量.(精确到0.01)
【考点】根据化学反应方程式的计算.
【专题】压轴实验题;图表分析,寻找有效数据;有关化学方程式的计算.
【分析】(1)第四次加入稀盐酸,剩余固体质量不再减小,说明剩余固体全部为杂质,样品碳酸质量则为样品与杂质质量差;利用碳酸钙质量与样品质量比,计算该石灰石样品中碳酸钙的质量分数;
(2)前三次实验所加盐酸完全反应,可根据这三次实验数据,由参加反应碳酸钙的质量计算出5g或15g稀盐酸中含有HCI的质量,然后根据20g稀盐酸与所计算稀盐酸质量关系,计算20g稀盐酸中含有HCI的质量.
【解答】解:(1)该石灰石样品中碳酸钙的质量分数=
 ×100%=75%
×100%=75%
(2)由表中数据可知第三次加入5g稀盐酸后,3g碳酸钙与15g稀盐酸刚好完全反应.
设15g稀盐酸中的HCl质量为x
CaC03+2HCl═CaCl2+H20+C02↑
100 73
3g x

 =
=

x=2.19g
20g稀盐酸的溶质HCI质量为:2.19g×
 =2.92g
=2.92g
答:(1)计算该石灰石样品中碳酸钙的质量分数75%;(2)20g稀盐酸的溶质HCI质量为2.92g.
(2)解法二:由表中数据可知第一次(第二次)加入5g稀盐酸后,1g碳酸钙与5g稀盐酸刚好完全反应.
设5g稀盐酸中的HCl质量为x
CaC03+2HCl═CaCl2+H20+C02↑
100 73
1g x
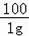
 =
=
 x=0.73g
x=0.73g
20g稀盐酸的溶质HCI质量为:0.73g×4=2.92g
答:20g稀盐酸的溶质HCI质量为2.92g.
【点评】根据剩余固体不再与盐酸发生反应,得到剩余固体即为样品中的杂质结论,从而解决样品中所含量碳酸钙的质量.
