如图为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:


(1)请写出上述元素d的价电子排布式 ;
(2)请写出j的单质与a、h形成的化合物发生反应的化学方程式 ;
(3)请比较b、e、j三种元素的第一电离能由大到小的顺序 (写元素符号);
(4)请写出e元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式 ;
(5)j、k、l三种元素之间能以原子个数比1:1两两形成互化物,这些互化物的性质类似于这些元素单质的性质.请写出k、l的互化物的电子式 ,它是由 键形成的(根据原子轨道的重叠程度填写).
【考点】位置结构性质的相互关系应用;元素周期律和元素周期表的综合应用.
【分析】由图可知,a为H、b为Mg、c为K、d为Fe、e为Al、f为C、h为O,i为F,j为Cl,k为Br,l为I,g为Ge,
(1)Fe为第ⅤⅢ族元素,原子序数为26;
(2)氯气与水反应生成盐酸和HClO;
(3)非金属性越强,第一电离能越大,Mg的3s为全满稳定结构;
(4)氢氧化铝和NaOH反应生成偏铝酸钠和水;
(5)k、l的互化物为IBr,含I﹣br键,为共价单键.
【解答】解:由图可知,a为H、b为Mg、c为K、d为Fe、e为Al、f为C、h为O,i为F,j为Cl,k为Br,l为I,g为Ge,
(1)Fe为第ⅤⅢ族元素,原子序数为26,则d的价电子排布式为3d54s1,故答案为:3d54s1;
(2)氯气与水反应生成盐酸和HClO,化学反应方程式为Cl2+H2O=HClO+HCl,故答案为:Cl2+H2O=HClO+HCl;
(3)非金属性越强,第一电离能越大,Mg的3s为全满稳定结构,b、e、j三种元素的第一电离能由大到小的顺序为Cl>Mg>Al,故答案为:Cl>Mg>Al;
(4)氢氧化铝和NaOH反应生成偏铝酸钠和水,反应离子方程式为Al(OH)3+OH﹣=AlO2﹣+2H2O,故答案为:Al(OH)3+OH﹣=AlO2﹣+2H2O;
(5)k、l的互化物为IBr,电子式为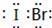
 ,含I﹣br键,为共价单键,属于σ键形成的,故答案为:
,含I﹣br键,为共价单键,属于σ键形成的,故答案为: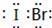
 ;σ.
;σ.


