向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3![]() Fe(NO3)3+NO↑+H2O
Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段反应的离子方程式.
(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式.
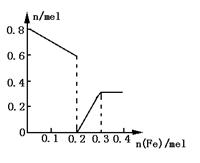
(3)在图中画出溶液中Fe2+、![]() 离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).
离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).
向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3![]() Fe(NO3)3+NO↑+H2O
Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段反应的离子方程式.
(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式.
(3)在图中画出溶液中Fe2+、![]() 离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).
离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).

(1)Fe+4H++![]()
![]() Fe3++NO↑+2H2O
Fe3++NO↑+2H2O
2Fe3++Fe![]() 3Fe2+.
3Fe2+.
(2)①加入Fe粉为0~0.2mol时,存在形式为Fe3+.
②加入铁粉为0.2~0.3mol时,存在形式为Fe2+和Fe3+
③加Fe粉为n(Fe)≥0.3mol时,存在形式为Fe2+.
(3)如下图.
铁与稀硝酸反应规律
①Fe+4HNO3![]() Fe(NO3)3+NO↑+2H2O
Fe(NO3)3+NO↑+2H2O
②3Fe+8HNO3![]() 3Fe(NO3)2+2NO↑+4H2O
3Fe(NO3)2+2NO↑+4H2O
(1)当![]() ≤
≤![]() 时,按反应①进行;
时,按反应①进行;
当![]() ≥
≥![]() 时,按反应②进行.
时,按反应②进行.
当![]() ≤
≤![]() ≤
≤![]() 时,则①②两反应都发生,且Fe、HNO3均反应完全.
时,则①②两反应都发生,且Fe、HNO3均反应完全.
(2)上述反应可以认为先发生反应①,若Fe有剩余则发生2Fe(NO3)3+Fe![]() 3Fe(NO3)2.
3Fe(NO3)2.