一定温度下,在一固定体积的容器中,通人一定量的CO和H2O,发生如
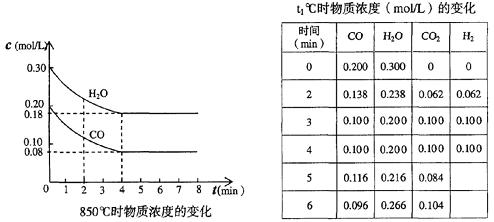
一定温度下,在一固定体积的容器中,通人一定量的CO和H2O,发生如下反应:CO(g)十H2O(g)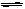 CO2(g)十H2 (g);△H<0
CO2(g)十H2 (g);△H<0
(1)在850℃时,CO和H2O浓度变化如下左图,则 0~4min的平均反应速率v(CO)=_ _mol·L-1·min-1
(2)t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如右上表。
①计算t1℃该反应的平衡常数为 ,t1℃ 850℃(填大于、小于或等于)。判断依据是________ _______。
②t1℃时,反应在4min—5min间,平衡 移动(填“向左”、“向右”或“不移动”),可能的原因是________。
a.增加CO的浓度 b.增加H2的浓度
c.加压 d.使用催化剂
(3)t2℃时,反应CO2(g)十H2 (g)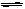 CO(g)十H2O(g)的平衡浓度符合[CO2]·[H2]=2[CO]·[H2O],则t2℃ 850℃(填大于、小于或等于)。
CO(g)十H2O(g)的平衡浓度符合[CO2]·[H2]=2[CO]·[H2O],则t2℃ 850℃(填大于、小于或等于)。
(1)0.03
(2)①0.5 大于 该反应正反应为放热反应,化学平衡常数随温度的升高而减小
② 向左 b
(3)小于
解析:
(1)0—4min CO的平均反应速率为:
v(CO)=(0.20-0.08) mol·L-1/4 min=0.03 mol·L-1·min-1
(2)t1℃时3min—4min为平衡状态,该反应的平衡常数为:
K(t1℃)={[CO2]·[H2]}/{[CO]·[H2O]}=(0.100×0.100)/( 0.100×0.200)=0.5
由左图知:850℃时,CO、H2O、CO2、H2的平衡浓度分别为:0.08 mol·L-1、0.18 mol·L-1=0.12 mol·L-1、(0.20-0.08) mol·L-1=0.12 mol·L-1、0.12 mol·L-1,平衡常数为K(850℃)= (0.12×0.12)/( 0.18×0.08)=1。K(t1℃)<K(850℃),故t1℃大于850℃,因为该反应正反应为放热反应,化学平衡常数随温度的升高而减小。
由右上表知:反应在4min—5min间,CO(g)和H2O(g)的浓度增大,CO2的浓度减小,只能是增加了H2的浓度,平衡向左移动。
(3)850℃时,CO2(g)十H2 (g)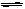 CO(g)十H2O(g)与原反应互为可逆反应,其平衡常数为K(850℃)也为1。t2℃时,由[CO2]·[H2]=2[CO]·[H2O]得,该温度下的平衡常数为:K(t2℃)={[CO]·[H2O]}/{[CO2]·[H2]}=1/2<1,故t2℃<850℃。
CO(g)十H2O(g)与原反应互为可逆反应,其平衡常数为K(850℃)也为1。t2℃时,由[CO2]·[H2]=2[CO]·[H2O]得,该温度下的平衡常数为:K(t2℃)={[CO]·[H2O]}/{[CO2]·[H2]}=1/2<1,故t2℃<850℃。
![]() CO2(g)十H2 (g);△H<0
CO2(g)十H2 (g);△H<0
![]() CO(g)十H2O(g)的平衡浓度符合[CO2]·[H2]=2[CO]·[H2O],则t2℃ 850℃(填大于、小于或等于)。
CO(g)十H2O(g)的平衡浓度符合[CO2]·[H2]=2[CO]·[H2O],则t2℃ 850℃(填大于、小于或等于)。