иө„ж–ҷдёҖпјҡеҺҹз…Өдёӯеҗ«жңүзЎ«пјҢзҮғзғ§ж—¶з”ҹжҲҗзҡ„SO2дјҡжұЎжҹ“з©әж°”пјӣ
иө„ж–ҷдәҢпјҡжөӢйҮҸSO2еҗ«йҮҸзҡ„еҸҚеә”еҺҹзҗҶдёәSO2+2H2O+I2в•җH2SO4+2HIпјӣ
иө„ж–ҷдёүпјҡеҠ дәҶз”ҹзҹізҒ°зҡ„еҺҹз…ӨзҮғзғ§ж—¶еҲ»еҮҸе°‘SO2жҺ’ж”ҫпјҢеҸҚеә”еҺҹзҗҶдёә2CaO+2SO2+O2 2CaSO4пјҺ
2CaSO4пјҺ
иҜ·еӣһзӯ”пјҡ
пјҲ1пјүеҺҹз…ӨзҮғзғ§дә§з”ҹзҡ„SO2еңЁйӣЁгҖҒйӣӘйҷҚиҗҪиҝҮзЁӢдёӯдјҡеҪўжҲҗгҖҖгҖҖпјҢе®ғиғҪи…җиҡҖе»әзӯ‘зү©гҖҒдҪҝеңҹеЈӨй…ёеҢ–зӯүпјӣ
пјҲ2пјүеҸ–з”ЁеҺҹз…ӨзҮғзғ§дә§з”ҹзҡ„е·Ҙдёҡеәҹж°”ж ·е“Ғ1зұі3пјҢзј“зј“йҖҡиҝҮеҗ«зўҳпјҲI2пјү1.27жҜ«е…Ӣзҡ„зўҳжә¶ж¶ІпјҢеҲҡеҘҪе®Ңе…ЁеҸҚеә”пјҺеҲҷиҜҘе·Ҙдёҡеәҹж°”дёӯSO2зҡ„еҗ«йҮҸдёәгҖҖжҜ«е…Ӣ/зұі3пјҢпјҲеҒҮи®ҫе·Ҙдёҡеәҹж°”дёӯзҡ„е…¶е®ғзү©иҙЁдёҚдёҺзўҳеҸҚеә”пјүпјӣ
пјҲ3пјүиӢҘиҜҘе·Ҙдёҡеәҹж°”дёӯеҗ«жңү128еҸҜSO2пјҢиҰҒйҷӨеҺ»иҝҷдәӣSO2пјҢзҗҶи®әдёҠйңҖеңЁдә§з”ҹиҜҘе·Ҙдёҡеәҹж°”зҡ„еҺҹз…ӨдёӯеҠ е…Ҙеҗ«ж°§еҢ–й’ҷ80%зҡ„з”ҹзҹізҒ°еӨҡе°‘е…ӢпјҲеҒҮи®ҫе·Ҙдёҡеәҹж°”дёӯзҡ„е…¶е®ғзү©иҙЁдёҚдёҺж°§еҢ–й’ҷеҸҚеә”пјүпјҹ
иҖғзӮ№пјҡ
еёёи§ҒжұЎжҹ“зү©зҡ„жқҘжәҗгҖҒеҚұе®іеҸҠжІ»зҗҶпјӣж №жҚ®еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸзҡ„и®Ўз®—пјҺ | | дё“йўҳпјҡ | еҢ–еӯҰдёҺз”ҹжҙ»пјӣжңүе…іеҢ–еӯҰж–№зЁӢејҸзҡ„и®Ўз®—пјҺ |
| еҲҶжһҗпјҡ | пјҲ1пјүеҺҹз…ӨзҮғзғ§дә§з”ҹзҡ„SO2еңЁйӣЁгҖҒйӣӘйҷҚиҗҪиҝҮзЁӢдёӯдјҡеҪўжҲҗй…ёйӣЁпјӣ пјҲ2пјүдҫқжҚ®еҢ–еӯҰж–№зЁӢејҸдёӯзўҳжә¶ж¶Ідёӯзўҳзҡ„иҙЁйҮҸеҸҜд»ҘжұӮеҮәдәҢж°§еҢ–зЎ«зҡ„иҙЁйҮҸпјӣ пјҲ3пјүз”ұдәҢж°§еҢ–зЎ«зҡ„иҙЁйҮҸпјҢз”ұеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸи®Ўз®—еҮәзҗҶи®әдёҠйңҖеҗ«ж°§еҢ–й’ҷ80%зҡ„з”ҹзҹізҒ°зҡ„иҙЁйҮҸеҚіеҸҜпјҺ |
| и§Јзӯ”пјҡ | и§ЈпјҡпјҲ1пјүеҺҹз…ӨзҮғзғ§дә§з”ҹзҡ„SO2еңЁйӣЁгҖҒйӣӘйҷҚиҗҪиҝҮзЁӢдёӯдјҡеҪўжҲҗй…ёйӣЁпјӣ пјҲ2пјүи®ҫ1m3е·Ҙдёҡ еәҹж°”дёӯеҗ«жңүSO2зҡ„иҙЁйҮҸдёәx SO2+2H2O+I2в•җH2SO4+2HI 64В В В В В 254 xВ В В В В В 1.27mg  = =
и§Јд№Ӣеҫ—пјҡx=0.32mg пјҲ3пјүи®ҫзҗҶи®әдёҠйңҖеҗ«ж°§еҢ–й’ҷ80%зҡ„з”ҹзҹізҒ°зҡ„иҙЁйҮҸдёәxпјҢ 2CaO+2SO2+O2в•җ2CaSO4 112В 128 80%xВ 128g 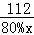 = =
и§Јд№Ӣеҫ—пјҡx=140g зӯ”пјҡзҗҶи®әдёҠйңҖеҗ«ж°§еҢ–й’ҷ80%зҡ„з”ҹзҹізҒ°зҡ„иҙЁйҮҸдёә140gпјҺ |
| зӮ№иҜ„пјҡ | жң¬йўҳдёәж №жҚ®еҢ–еӯҰж–№зЁӢејҸзҡ„еҹәжң¬и®Ўз®—пјҢдё»иҰҒжҳҜеҲ©з”Ёе·ІзҹҘйҮҸжұӮжңӘзҹҘйҮҸзҡ„еҹәзЎҖжҖ§и®Ўз®—пјҢйҡҫеәҰдёҚеӨ§пјҺ |
гҖҖ
![]() 2CaSO4пјҺ
2CaSO4пјҺ