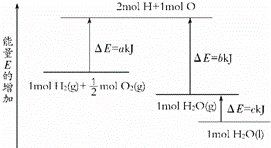
一定条件下,化学反应2H2+O2═2H2O的能量变化如图所示,则反应的热化学方程式可表示为()
A. H2(g)+![]() O2(g)═H2O(g)△H=(a+b) kJ•mol﹣1
O2(g)═H2O(g)△H=(a+b) kJ•mol﹣1
B. 2H2(g)+O2(g)═2H2O(g)△H=2(b﹣a) kJ•mol﹣1
C. H2(g)+![]() O2(g)═H2O(l)△H=(b+c﹣a) kJ•mol﹣1
O2(g)═H2O(l)△H=(b+c﹣a) kJ•mol﹣1
D. 2H2(g)+O2(g)═2H2O(l)△H=2(a﹣b﹣c) kJ•mol﹣1
一定条件下,化学反应2H2+O2═2H2O的能量变化如图所示,则反应的热化学方程式可表示为()

A. H2(g)+![]() O2(g)═H2O(g)△H=(a+b) kJ•mol﹣1
O2(g)═H2O(g)△H=(a+b) kJ•mol﹣1
B. 2H2(g)+O2(g)═2H2O(g)△H=2(b﹣a) kJ•mol﹣1
C. H2(g)+![]() O2(g)═H2O(l)△H=(b+c﹣a) kJ•mol﹣1
O2(g)═H2O(l)△H=(b+c﹣a) kJ•mol﹣1
D. 2H2(g)+O2(g)═2H2O(l)△H=2(a﹣b﹣c) kJ•mol﹣1
考点: 热化学方程式;反应热和焓变.
专题: 化学反应中的能量变化.
分析: 根据反应热等于反应物总能量减去生成物总能量计算反应热并书写热化学方程式,注意反应物的物质的量和生成物的聚集状态.
解答: 解:由图中分析判断,1molH2(g)+![]() molO2(g)的能量为aKJ,1molH2O(g)的能量为bKJ,所以H2(g)+
molO2(g)的能量为aKJ,1molH2O(g)的能量为bKJ,所以H2(g)+![]() O2(g)═H2O(g)△H=(a﹣b) kJ•mol﹣1,
O2(g)═H2O(g)△H=(a﹣b) kJ•mol﹣1,
1molH2O(g)转化为1molH2O(l)放热为cKJ,所以得到:H2![]() (g)+
(g)+![]() O2(g)═H2O(l)△H=(a﹣b﹣c) kJ•mol﹣1;
O2(g)═H2O(l)△H=(a﹣b﹣c) kJ•mol﹣1;
即2H2(g)+O2(g)═2H2O(l)△H=2(a﹣b﹣c) kJ•mol﹣1,
故选D.
点评: 本题考查热化学方程式的书写,题目难度不大,注意书写热化学方程式的注意事项以及反应热的计算方法.