某实验小组利用废硫酸制备K2SO4并研究CaSO4·2H2O加热分解的产物。
一、K2SO4的制备
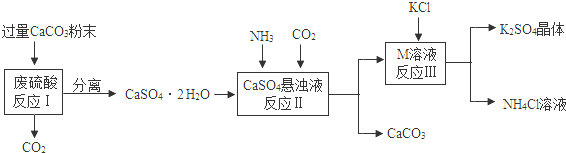
(1)将CaCO3研成粉末的目的是____________ _。
(2)上述流程中可循环使用的物质有CO2和__________(填写化学式)。
(3)反应III中相关物质的溶解度如下表。你认为反应III在常温下能实现的原因是________
____________。
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(常温) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应III所得晶体的目的是_____________________。
二、研究CaSO4·2H2O加热分解的产物
(5)分离所得的CaSO4·2H2O含有CaCO3,可用盐酸除去,该化学反应方程式为
________________________。
(6)为了测定CaSO4·2H2O和CaCO3的质量比x∶y,实验小组利用下图所示的装置(夹持仪器省略)进行实验。
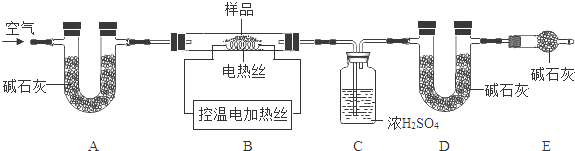
①实验前首先要________________,再装入样品。装置A的作用是_____________________。
②已知CaSO4·2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分
解完全。现控制B装置900℃进行实验采集了如下数据:
a.反应前玻璃管与样品的总质量m1g b.反应后玻璃管中固体的质量m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出的值x∶y,若无装置E,则实验测定结果将________(填“偏大”“偏小”或“无影响”)。若实验测得m3=1.8g, m4=2.2g,求x∶y的值(写出计算过程)。(已知CaSO4·2H2O的相对分子质量是172)

