将1 mol·L-1的FeCl3溶液逐滴滴入沸水中,液体变为______色,得到的是___
将1 mol·L
-1的FeCl
3溶液逐滴滴入沸水中,液体变为______色,得到的是_______________;反应的化学方程式为_________________________________________。
用此分散系进行实验:
(1)将其装入U形管内,用石墨棒作电极,接通直流电源,通电一段时间后发现阴极附近颜色__________,这表明__________,这种现象称为______________________________。
(2)向其中加入饱和(NH4)2SO4溶液,发生的现象是_______________________________;原因是__________________________________________。
(3)向其中逐滴加入过量稀硫酸,现象是_________________________________________;原因是______________________________________________________________。
解析:本题考查胶体的制备及性质。已知Fe(OH)3胶体带正电荷,所以通电时Fe(OH)3胶体向阴极移动,发生电泳;加入电解质可发生胶体的聚沉。由于Fe(OH)3是一种弱碱,所以可溶于过量的稀H2SO4。
答案:红褐 Fe(OH)3胶体 FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
(1)逐渐变深 Fe(OH)3胶粒带正电荷 胶体的电泳
(2)形成红褐色沉淀 (NH4)2SO4电离出的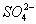 中和Fe(OH)3胶体所带的正电荷,使微粒变大,生成沉淀
中和Fe(OH)3胶体所带的正电荷,使微粒变大,生成沉淀
(3)先出现红褐色沉淀,后沉淀消失 H2SO4使Fe(OH)3胶体发生聚沉,过量的H2SO4又将沉淀溶解
