下图是工业接触法制硫酸的简单流程图:(1)若沸腾炉中每燃烧0.12 kg F
下图是工业接触法制硫酸的简单流程图:
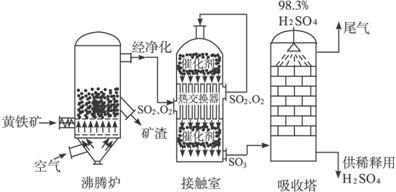
(1)若沸腾炉中每燃烧0.12 kg FeS2放了853 kJ热量,写出此状况下FeS2燃烧的热化学方程式___________________________。
(2)反应2SO2+O2 2SO3是在500 ℃恒温密闭的接触室中进行的,能充分说明此反应已达到平衡的标志是_________(填序号)。
2SO3是在500 ℃恒温密闭的接触室中进行的,能充分说明此反应已达到平衡的标志是_________(填序号)。
①接触室中SO2、O2、SO3共存
②接触室中SO2、O2、SO3的浓度相同
③接触室中SO2、SO3的物质的量之比为2∶1∶2
④接触室中压强不随时间变化而变化
(3)从沸腾炉出来的气体经净化干燥处理后进入接触室,其气体体积组成是:SO27%,O211%,N282%。若有100体积这样的混合气体在接触室反应,一段时间后,气体总体积变为96.7体积,则反应后混合气体中N2和O2的体积比为_________,此时SO2的转化率为_________。
(1)FeS2(s)+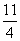 O2(g)
O2(g)
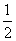 Fe2O3(s)+2SO2(g);ΔH=-853 kJ·mol-1
Fe2O3(s)+2SO2(g);ΔH=-853 kJ·mol-1
(2)④
(3)82∶7.7 94.3%
解析:本题考查硫酸的工业制法。
①0.12 kg即1 mol FeS2燃烧放了853 kJ热量,所以热化学方程式为:FeS2(s)+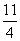 O2(g)
O2(g) 
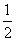 Fe2O3(s)+2SO2(g);ΔH=-853 kJ·mol-1。
Fe2O3(s)+2SO2(g);ΔH=-853 kJ·mol-1。
②反应2SO2+O2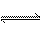 2SO3是不等体积的反应,所以只有达到平衡时物质的量不变,所以压强不变。本反应为可逆反应,所以接触室中SO2、O2、SO3一直共存,②③不一定。
2SO3是不等体积的反应,所以只有达到平衡时物质的量不变,所以压强不变。本反应为可逆反应,所以接触室中SO2、O2、SO3一直共存,②③不一定。
③由题意可知SO27体积,O211体积,N282体积。一段时间后,气体总体积变为96.7体积,则反应消耗SO26.6体积,O23.3体积,剩余O27.7体积,所以N2和O2的体积比为82∶7.7。
SO2的转化率=6.6/7×100%=94.3%。

![]() 2SO3是在
2SO3是在