有甲、乙、丙三种常见短周期元素,它们之间两两化合可以生成化合物戊、己、庚。化合物戊、己、庚之间也能相互反应,已知戊是由甲和乙两元素按原子个数比为1:1组成的化合物,甲、乙、丙三元素形成的单质(仍用甲、乙、丙表示)和它们组成的化合物之间的反应关系如下(未配平):
①乙+丙
己 ②甲+丙

庚 ③戊+己

丁
④戊+庚
丙+辛 ⑤己+庚

丙+辛
若丁的用途如下图所示,试完成下列问题:
(1)写出下列物质的化学式:
己:_______________________________________________________________;
庚:_______________________________________________________________;
丁:_______________________________________________________________。

(2)写出下列反应的化学方程式:
反应③:_____________________________________________________;
反应④:______________________________________________________。
(3)298 K时向体积为V L的真空容器内通入n mol 己和m mol庚。
①若n=2,则当m=_____________时,反应后容器内气体的密度最小。
②若2n>m,则反应后氧化产物与还原产物的质量差为____________________g。
③若5n=m,则反应后氧化产物与还原产物的质量和为48 g,则n+m=_______________。
(1)SO2 H2S H2SO4
(2)H2O2+SO2 H2SO4
H2SO4
H2O2+H2S S↓+2H2O
S↓+2H2O
(3)①4 ②16m ③3
解析:(1)题图为硫酸的用途图,丁为硫酸。因为戊是由甲和乙两元素组成的化合物,由反应①②③知丁(H2SO4)是由甲、乙、丙(H、O、S)三元素组成的,甲为H元素,乙为O元素,丙是S元素,戊为H2O2,己为SO2,庚为H2S,辛为H2O。
(2)根据(1)的结论,反应③的化学方程式为:H2O2+SO2 H2SO4;反应④的化学方程式为:H2O2+H2S
H2SO4;反应④的化学方程式为:H2O2+H2S S↓+2H2O。
S↓+2H2O。
(3)①当真空容器内H2S和SO2恰好完全反应时气体密度最小为0,即
2H2S + SO2 3S↓+H2O
3S↓+H2O
m 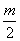
故有n=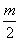
=2,m=4。
②由2n>m可推知:n:m>1:2,即SO2过量,H2S完全反应:
SO2 + 2H2S 2S + S + 2H2O
2S + S + 2H2O
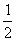
m m m
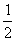
m
故氧化产物与还原产物质量差为:(m-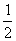
m)×32=16m(g)
③由5n=m可推出:n:m=n:5n=1:5<1:2,即H2S过量,SO2完全反应,氧化产物与还原产物总的物质的量为3n mol,则3n×32=48,n=0.5,故n+m=6n=3。
![]()
![]()

