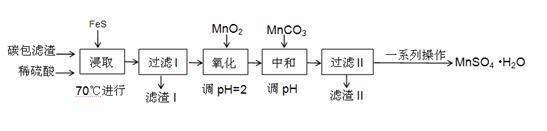
某学习小组利用废旧电池拆解后的碳包滤渣(含MnO2、C、Hg2+ 等)制取硫酸锰晶体( MnSO4·H2O ),实验流程如下:
已知:(1)25℃ 时,几种硫化物的溶度积常数如下:
| 物质 | FeS | MnS | HgS |
| 溶度积 | 5×10-18 | 4.6×10-14 | 2×10-54 |
(2)25℃ 时, 几种金属氢氧化物沉淀时的PH如下:
| Fe(OH)2 | Fe(OH)3 | Mn (OH)2 | |
| 开始沉淀时的PH | 6.3 | 2.7 | 8.3 |
| 沉淀完全时的PH | 8.4 | 3.7 | 9.8 |
请回答下列问题:
(1)“浸取”时加热的作用是 ;
写出“浸取”时生成MnSO4、Fe2(SO4)3 反应的离子方程式: 。
(2)若“浸取”在25℃时进行,加入足量FeS,![]() 则FeS(s)+ Hg2+(aq)
则FeS(s)+ Hg2+(aq) ![]() HgS(s)+ Fe2+ (aq)的平衡常数K为 。
HgS(s)+ Fe2+ (aq)的平衡常数K为 。
(3)滤渣I的主要成分为FeS 、S 和 (化学式) 。
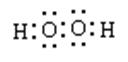
(4)“氧化”时加入MnO2 的作用是 ,也可用H2O2 代替MnO2 ,H2O2 的电子式为 。
(5)“中和”过程,应该调节溶液PH为 ,
写出该过程产生滤渣II的离子方程式:
(6)1150℃ 时,MnSO4·H2O 在氩气氛围中进行焙烧的分解产物是Mn3O4、硫的氧化物
等,分解反应的化学方程式是: