按核电荷数的增加,依照一定的规律将1~18号元素顺次排列成如表.
| 最外层电子数 电子层数 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | ⅤⅡ | 0 |
| 一 | H | / | / | / | / | / | / | He |
| 二 | Li | Be | B | C | N | O | F | Ne |
| 三 | Na | Mg | Al | Si | P | S | Cl | Ar |
运用所学过的核外电子排布的初步知识,根据上表进行填空.
(1)在化学反应中,第Ⅰ纵列的元素比较容易 电子;第Ⅵ纵列、第Ⅶ纵列的元素比较容易 电子,(除去H之外)通常都达到8电子的稳定结构,可见元素的化学性质主要决定于原子的 子 数.
(2)从原子结构上看同一横行的元素具有相同的 数,同一纵列的元素具有相同的 数.
(3)在表中,和氖原子核外电子排步相同的两种阴离子的结构示意图分别是和,三种阳离子的离子符号分别是 、+ 、 .
考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;化学符号及其周围数字的意义.
专题: 化学用语和质量守恒定律.
分析: (1)根据原子结构示意图知,金属元素的原子最外层电子数一般少于4个,非金属元素的原子最外层电子数一般多于4个;金属元素在化学反应中易失去电子,非金属元素在化学反应中易得到电子,元素的化学性质与最外层电子数有关;
(2)根据原子结构示意图进行分析解答本题;
(3)根据和Ne原子核外电子排布相同的两种阴离子是氧离子和氟离子;阳离子是钠离子,镁离子或铝离子;
依据离子结构示意图的表示方法和离子符合的表示方法,进行解答.
解答: 解:(1)根据原子结构示意图和金属元素的原子最外层电子数一般少于4个,非金属元素的原子最外层电子数一般多于4个;金属元素在化学反应中易失去电子,非金属元素在化学反应中易得到电子,元素的化学性质与最外层电子数有关;
故答案为:失去;得到;最外层电子;
(2)根据原子结构示意图分析可知:同一横行的元素具有相同的电子层数;同一纵行的元素具有相同的最外层电子数;
同一周期中最外层电子数1到8依次增大等;故答案为:电子层;最外层电子;
(3)根据和Ne原子核外电子排布相同的两种阴离子是氧离子和氟离子;结构示意图为: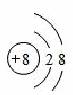 和
和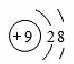 .阳离子是钠离子表示为:Na+,镁离子表示为Mg2+和铝离子表示为:Al3+;故填:Na+,Mg2+;Al3+.
.阳离子是钠离子表示为:Na+,镁离子表示为Mg2+和铝离子表示为:Al3+;故填:Na+,Mg2+;Al3+.
点评: 本题考查学生对微粒结构示意图知识的理解与掌握,并能应用元素周期律的知识进行分析解题的能力.


