可逆反应N2+3H22NH3是工业上合成氨的重要反应。
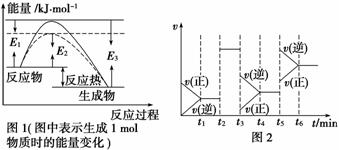
(1)根据图1请写出合成氨的热化学方程式__________________________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的________条件,该条件的改变与图2中哪一时刻条件的改变相同________(用“t1~t6”表示)。
(3)t3时刻改变的条件是____________,t5时刻改变的条件是____________。
可逆反应N2+3H22NH3是工业上合成氨的重要反应。

(1)根据图1请写出合成氨的热化学方程式__________________________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的________条件,该条件的改变与图2中哪一时刻条件的改变相同________(用“t1~t6”表示)。
(3)t3时刻改变的条件是____________,t5时刻改变的条件是____________。
解析 (1)根据图1可知,从N2和H2反应生成1 mol NH3过程中放出的热量为(E3-E1) kJ,所以N2与H2反应生成NH3的热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-2(E3-E1) kJ·mol-1。
2NH3(g) ΔH=-2(E3-E1) kJ·mol-1。
(2)图1中虚线部分表示由反应物到达过渡态的过程中,所需能量减少,说明使用了催化剂,降低了活化能。因为反应N2+3H2![]() 2NH3为反应前后气体体积不相等的反应,在图2中,t2时刻改变条件,正、逆反应速率的改变相同,说明改变的外界条件只能是使用了催化剂。
2NH3为反应前后气体体积不相等的反应,在图2中,t2时刻改变条件,正、逆反应速率的改变相同,说明改变的外界条件只能是使用了催化剂。
(3)t3时改变条件,v(正)、v(逆)都减小,且v(正)<v(逆),平衡向逆反应方向移动,改变的条件为减小压强;t5时改变条件,v(正)、v(逆)都增大,且v(逆)>v(正),平衡向逆反应方向移动,只能是升高温度。
答案 (1)N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-2(E3-E1) kJ·mol-1 (2)
2NH3(g) ΔH=-2(E3-E1) kJ·mol-1 (2)![]() 催化剂 t2~t3
催化剂 t2~t3
(3)减小压强 升高温度