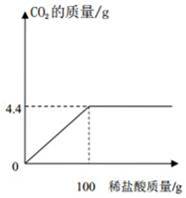
某化学兴趣小组欲测定碳酸钙样品的纯度(杂质不与盐酸反应)取12.5g样品加入到稀盐酸中,产生CO2的质量与稀盐酸的质量关系如图所示,请回答:
(1)该实验最多制得CO2的质量为 g.
(2)该碳酸钙样品的纯度为 .
(3)计算所加稀盐酸的溶质质量分数.(要求有计算过程)

某化学兴趣小组欲测定碳酸钙样品的纯度(杂质不与盐酸反应)取12.5g样品加入到稀盐酸中,产生CO2的质量与稀盐酸的质量关系如图所示,请回答:
(1)该实验最多制得CO2的质量为 g.
(2)该碳酸钙样品的纯度为 .
(3)计算所加稀盐酸的溶质质量分数.(要求有计算过程)


【考点】根据化学反应方程式的计算;有关溶质质量分数的简单计算.
【分析】根据图可以看出生成二氧化碳的质量,进而结合二氧化碳的质量和碳酸钙与盐酸反应的化学方程式求算碳酸钙的质量和HCl的质量,然后求算对应的质量分数.
【解答】解:由图可以看出生成的二氧化碳的质量为4.4g.
设参加反应的碳酸钙的质量为x,HCl的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 4.4g
![]()
![]() =
=![]()
![]() =
=![]()
![]()
x=10g
y=7.3g
则样品中碳酸钙的质量分数即纯度为![]()
![]() ×100%=80%
×100%=80%
所用盐酸中溶质的质量分数![]()
![]() ×100%=7.3%.
×100%=7.3%.
答案为:(1)4.4; (2)80%;(3)7.3%.