已知在酸性条件下发生的反应为AsO+2I-+2H+===AsO+I2+H2
已知在酸性条件下发生的反应为AsO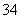 +2I-+2H+===AsO
+2I-+2H+===AsO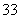 +I2+H2O,在碱性条件下发生的反应为AsO
+I2+H2O,在碱性条件下发生的反应为AsO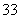 +I2+2OH-===AsO
+I2+2OH-===AsO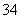 +H2O+2I-。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
+H2O+2I-。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:

Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现检流计指针均发生偏转。
试回答下列问题:
(1)两次操作中指针为什么发生偏转?
(2)两次操作过程中指针偏转方向为什么相反?试用化学平衡移动原理解释之。
(3)操作Ⅰ过程中C1棒上发生的反应为______________________________________;
(4)操作Ⅱ过程中C2棒上发生的反应为______________________________________。
(5)操作Ⅱ过程中,盐桥中的K+移向______烧杯溶液(填“A”或“B”)。
答案 (1)两次操作中均能形成原电池,化学能转变成电能。
(2)操作Ⅰ加酸,c(H+)增大,AsO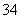 得电子,I-失电子,所以C1是负极,C2是正极。操作Ⅱ加碱,c(OH-)增大,AsO
得电子,I-失电子,所以C1是负极,C2是正极。操作Ⅱ加碱,c(OH-)增大,AsO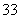 失电子,I2得电子,此时,C1是正极,C2是负极。故发生不同方向的反应,电子转移方向不同,即检流计指针偏转方向不同。
失电子,I2得电子,此时,C1是正极,C2是负极。故发生不同方向的反应,电子转移方向不同,即检流计指针偏转方向不同。
(3)2I--2e-===I2
(4)AsO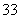 +2OH--2e-===AsO
+2OH--2e-===AsO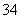 +H2O
+H2O
(5)A
解析 由于酸性条件下发生反应AsO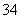 +2I-+2H+===AsO
+2I-+2H+===AsO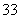 +I2+H2O,碱性条件下发生反应AsO
+I2+H2O,碱性条件下发生反应AsO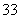 +I2+2OH-===AsO
+I2+2OH-===AsO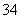 +H2O+2I-都是氧化还原反应。而且满足构成原电池的三大要素:①不同环境中的两电极(连接);②电解质溶液(电极插入其中并与电极自发反应);③形成闭合回路。
+H2O+2I-都是氧化还原反应。而且满足构成原电池的三大要素:①不同环境中的两电极(连接);②电解质溶液(电极插入其中并与电极自发反应);③形成闭合回路。
当加酸时,c(H+)增大,C1:2I--2e-===I2,是负极;C2:AsO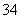 +2H++2e-===AsO
+2H++2e-===AsO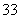 +H2O,是正极。
+H2O,是正极。
当加碱时,c(OH-)增大,C1:I2+2e-===2I-,是正极;C2:AsO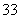 +2OH--2e-===AsO
+2OH--2e-===AsO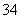 +H2O,是负极。
+H2O,是负极。
![]() +2I-+2H+===AsO
+2I-+2H+===AsO![]() +I2+H2O,在碱性条件下发生的反应为AsO
+I2+H2O,在碱性条件下发生的反应为AsO![]() +I2+2OH-===AsO
+I2+2OH-===AsO![]() +H2O+2I-。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
+H2O+2I-。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
