向仅含SO32-、I-、Br-且物质的量分别为m、n、6 mol 的钠盐溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )
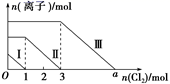
A.曲线Ⅱ代表Br-的变化情况
B.曲线Ⅰ对应的反应:SO32-+Cl2+H2O=2H++SO42-+2Cl-
C.通入的氯气为5 mol时,溶液中的主要阴离子为Cl-、SO32-
D.溶液中n(Na+)=n(SO32-)+n(I-)+n(Br-)
向仅含SO32-、I-、Br-且物质的量分别为m、n、6 mol 的钠盐溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )

A.曲线Ⅱ代表Br-的变化情况
B.曲线Ⅰ对应的反应:SO32-+Cl2+H2O=2H++SO42-+2Cl-
C.通入的氯气为5 mol时,溶液中的主要阴离子为Cl-、SO32-
D.溶液中n(Na+)=n(SO32-)+n(I-)+n(Br-)
B
【详解】
向仅含SO32-、I-、Br-的溶液中通入适量氯气,还原性为SO32->I->Br-,首先发生反应H2O+SO32-+Cl2=SO42-+2Cl-+2H+,图中曲线I表示SO32-变化,然后发生2I-+Cl2=I2+2Cl-,故曲线II表示I-的变化,最后发生2Br-+Cl2=Br2+2Cl-,曲线III表示Br-的变化;
A.由上述分析可知,曲线II表示I-的变化,故A错误;
B.由还原性的强弱可知,曲线Ⅰ对应的反应:SO32-+Cl2+H2O═2H++SO42-+2Cl-,故B正确;
C.由图可知,通入的氯气为1 mol时,溶液中不存在SO32-,故C错误;
D.由电荷守恒可知,溶液中n(Na+)=2n(SO32-)+n(I-)+n(Br-),故D错误;
故答案为B。
【点睛】
考查氧化还原反应,把握离子的还原性强弱、反应与图象的对应关系为解答的关键,向仅含SO32-、I-、Br-的溶液中通入适量氯气,还原性为SO32->I->Br-,则依次发生的氧化还原反应为H2O+SO32-+Cl2=SO42-+2Cl-+2H+、2I-+Cl2=I2+2Cl-和2Br-+Cl2=Br2+2Cl-。