(08年厦门市适应性考试)
为测定过氧化氢溶液的浓度,小明将一定量的过氧化氢溶液加入如图1的锥形瓶中,再加入少量二氧化锰,待反应完成后,称量锥形瓶和剩余物质的总质量。
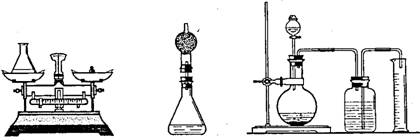
(图1) (图2) (图3)
小明进行了四次实验,结果如下表:
序号 | 锥形瓶质量(g) | 过氧化氢溶液体积(mL) | 二氧化锰质量(g) | 反应完成后锥形瓶和剩余物质总质量(g) |
1 | 80.0 | 100.0 | 1.6 | 180.2 |
2 | 80.0 | 100.0 | 1.6 | 179.8 |
3 | 80.0 | 100.0 | 1.6 | 180.0 |
4 | 80.0 | 100.0 | 1.6 | 182.6 |
请回答下列问题:(假设过氧化氢溶液的密度为1 g •cm-3,实验在标准状况下进行)
(1)写出上述反应的化学方程式 ;
(2)若以上表中的数据计算,该过氧化氢溶液的物质的量浓度是 ;
(3)若用图2装置代替图1中的锥形瓶进行实验,结果将更准确,其理由是 ;
(4)若用图3装置代替图2进行实验,结果将更加准确,其理由是 ;
(5)若过氧化氢溶液的浓度约为1mol •L-1,取20.0 mL该溶液按图3方案进行实验,则该实验应选用的量筒规格是 ( );
A.1000 mL B. 500 mL C. 250 mL D. 100 mL
(6)有人认为上述三个方案均不够好,可以采用滴定的方法进行测定,其反应原理为:
2KMnO4+5H2O2+3H2SO4==K2SO4+2MnSO4+5O2↑+8H2O
若过氧化氢溶液的浓度约为1mol •L-1,取10.0 mL,用0.5000 mol•L-1酸化的高锰酸钾溶液进行滴定。则:
①滴定时,盛装高锰酸钾溶液应选用 (填“酸式”或“碱式”)滴定管;
②判断到达滴定终点的现象是 ;
③实验时,需要记录的数据有 ;
④消耗的酸化高锰酸钾溶液的体积约为 mL。
