有一包白色粉末,可能由CaCO3、Na2SO4、KNO3、CuSO4、Na2CO3中的一种或几种组成,为鉴定其组成,现进行一下实验:
(1)取少量白色粉末加足量水溶解,得无色溶液;
(2)在此溶液中加入少量氯化钡溶液,生成白色沉淀;
(3)过滤,在白色沉淀中加入足量的稀硝酸,沉淀无变化.
由(1)判断该粉末中一定不含有 .
由(2)(3)判断:该粉末中一定含有 ,一定不含有 .
为进一步确定白色粉末的组成小辉同学取2g该粉末加足量水溶解后,又加入足量的氯化钡溶液,过滤,洗涤、烘干后,称量白色沉淀为2.33g、通过计算,此粉末的组成是 .
分析:
根据铜离子在溶液中显蓝色,碳酸钙难溶于水,但是会溶于酸,钡离子会与硫酸根离子生成的硫酸钡沉淀难溶于酸进行分析固体的组成. 根据沉淀的质量可以求出原来的白色粉末中含有的硫酸钠质量,进而可以判断硝酸钾是否含有; | | 解答: | 解:将此固体粉末投入到足量水中,得无色溶液且没有沉淀产生,说明一定不存在溶液中呈蓝色硫酸铜和不溶于水的碳酸钙生成,加入少量氯化钡溶液,生成白色沉淀;则说明溶液中存在能与氯化钡反应生成沉淀的碳酸钠或硫酸钠或两者都有;因为得到的白色沉淀不溶于硝酸,所以一定存在硫酸钠一定不存在碳酸钠(硫酸钡沉淀不溶于硝酸,碳酸钡沉淀溶于硝酸),而硝酸钾是否含有无法确定; 设生成2.33克的沉淀需要硫酸钠的质量为x BaCl2+Na2SO4=2NaCl+BaSO4↓ 142 233 x 2.33g 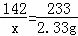
x=1.42g 由于固体的质量是2g,所以该固体中还含有硝酸钾,质量是2g﹣1.42g=0.58g 故答案为:硫酸铜、碳酸钙;硫酸钠;碳酸钠;1.42g硫酸钠和0.58g硝酸钾; |
