某校化学兴趣小组用所配制的稀盐酸,测定该某矿山上的石灰石样品中碳酸钙的质量分数,假设矿石中只含杂质二氧化硅(二氧化硅是一种极难溶于水也不与盐酸反应且耐高温的固体),他们取一块,将其粉碎后,称出11g放入烧杯内(烧杯的质量为20g),然后加入100g所配制的稀盐酸,用玻璃棒搅拌至不再产生气泡为止,二者恰好完全反应,得到下列数据,请分析表格中的数据,回答下列问题
| | 实验前 | 实验后 |
| 实验数据 | 烧杯和石灰石质量 | 加入盐酸质量 | 反应后混合物质量 |
| 31g | 100g | 126.6g |
(1)生成二氧化碳的质量为多少?
(2)此石灰石样品碳酸钙的质量分数为多少?
(3)将反应后混合物过滤,将滤液蒸发掉多少克水后可得到某温度下氯化钙的饱和溶液(某温度下,氯化钙的溶解度为25克)(计算结果保留一位小数)
(4)若某石灰厂在矿山上开采出这样的矿石550吨,最后可得含杂质的生石灰多少吨?
【考点】根据化学反应方程式的计算.
【专题】综合计算(图像型、表格型、情景型计算题).
【分析】(1)根据质量守恒定律可以计算出二氧化碳的质量;
(2)根据二氧化碳的质量可以计算出碳酸钙的质量,然后求出其质量分数即可;
(3)根据氯化钙的溶解度,及反应后氯化钙溶液的质量分数即可完成解答;
(4)根据碳酸钙的质量分数结合碳酸钙分解的化学方程式可以计算出氧化钙的质量,然后完成解答即可.
【解答】解:(1)根据质量守恒定律可以知道生成二氧化碳的质量为:31g+100g﹣126.6g=4.4g;
(2)设生成碳酸钙的质量为x,生成氯化钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
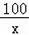
 =
=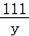
 =
=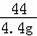

解得:x=10g y=11.1g
此石灰石样品碳酸钙的质量分数为: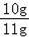
 ×100%=90.9%
×100%=90.9%
(3)设需要蒸发掉的水的质量为z
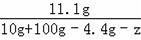
 =
=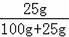

解得:z=50.1g
(4)550t矿石中含碳酸钙的质量为:550t×90.9%=500t
设可以得到氧化钙的质量为a
CaCO3
 CaO+CO2↑
CaO+CO2↑
100 56
500t a
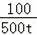
 =
=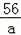

解得:a=56t
所以可以得到含杂质的生石灰的质量为:56t+(550t﹣500t)=106t
答:(1)生成二氧化碳的质量为4.4g;
(2)此石灰石样品碳酸钙的质量分数为90.9%;
(3)将反应后混合物过滤,将滤液蒸发掉50.1g克水后可得到某温度下氯化钙的饱和溶液;
(4)最后可得含杂质的生石灰106吨.
【点评】本考点考查了根据化学方程式的计算,要充分利用“遇到差值想气体”,根据质量守恒定律求气体的质量,然后再求其它物质的质量,做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律,本考点主要出现在计算题中.
