空气吹出法是目前海水提溴的最主要方法之一。其工艺流程如图所示:
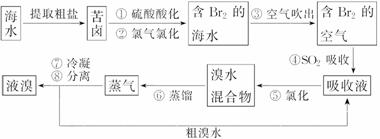
(1)步骤④利用了SO2的还原性,反应的离子方程式为
________________________________________________________________________。
(2)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差较大的特点进行分离。所用分离仪器的名称是________。
(3)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过空气吹出、SO2吸收、氯化后再蒸馏,这样操作的意义是_____________________________________。
(4) 根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是________________。
答案:(1)Br2+SO2+2H2O===4H++2Br-+SO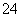 (2)分液漏斗
(2)分液漏斗
(4)空气吹出、SO2吸收、氯化的过程实际上是Br2的浓缩过程,与直接蒸馏含Br2的海水相比效率更高,消耗能源少,成本降低
(4) Cl2>Br2>SO2
解析:根据反应流程图和反应原理可知:海水提取溴主要分为海水中溴的浓缩和溴的蒸馏过程。利用Cl2的氧化性,SO2的还原性,将Br2与海水中其它物质分离,浓缩后的溴水混合物溴的浓度较高,较容易得到纯净的液溴。(1)利用Br2的氧化性和SO2的还原性进行反应提纯,离子方程式为:Br2+SO2+2H2O===4H++2Br-+SO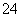 ;(2)液溴的密度比溴水的大的多,混合后分层,利用分液漏斗分离;(3)海水中Br2的含量很低,处理量太大,从效率和成本角度考虑,应经过流程图中的过程更适于工业生产;(4) 由反应2Br-+Cl2===Br2+2Cl-、SO2+Br2+2H2O===H2SO4+2HBr知氧化性由强到弱的顺序为:Cl2>Br2>SO2。
;(2)液溴的密度比溴水的大的多,混合后分层,利用分液漏斗分离;(3)海水中Br2的含量很低,处理量太大,从效率和成本角度考虑,应经过流程图中的过程更适于工业生产;(4) 由反应2Br-+Cl2===Br2+2Cl-、SO2+Br2+2H2O===H2SO4+2HBr知氧化性由强到弱的顺序为:Cl2>Br2>SO2。

