在温度T℃下,某Ba(OH)2稀溶液中c(H+)=10﹣amol/L,c(OH﹣)=10﹣bmol/L,已知a+b=12,向该溶液中逐滴加入NaHSO4溶液,测得混合溶液的部分PH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的PH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | X | 7 |
| ③ | 33.00 | 33.00 | 6 |
(1)依据题意判断,T℃ 大于 25℃(填“大于”、“小于”或“等于”)
(2)b= 4 ,X= 27
(3)反应③的离子方程式为: Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中c(Ba2+):c(OH﹣) 1:20 .
考点:
酸碱混合时的定性判断及有关ph的计算. | | 专题: | 电离平衡与溶液的pH专题. |
| 分析: | 温度T℃下,某Ba(OH)2稀溶液中c(H+)=10﹣amol/L,c(OH﹣)=10﹣bmol/L,a+b=12,c(H+).c(OH﹣)=10﹣12mol/L, (1)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大; (2)该温度下,溶液的pH=6时呈中性,①中溶液的pH=8,则Ba(OH)2稀溶液中 mol/L=10﹣4mol/L,③混合溶液pH=6,说明溶液呈中性,溶液体积相等,则氢离子浓度和氢氧根离子的浓度相等,所以NaHSO4溶液中c(H+)=10﹣4mol/L, mol/L=10﹣4mol/L,③混合溶液pH=6,说明溶液呈中性,溶液体积相等,则氢离子浓度和氢氧根离子的浓度相等,所以NaHSO4溶液中c(H+)=10﹣4mol/L, pH=7>6,说明溶液呈碱性,则溶液中 mol/L=10﹣5mol/L,根据混合溶液中c(OH﹣)计算X值; mol/L=10﹣5mol/L,根据混合溶液中c(OH﹣)计算X值; (3)反应③中氢离子和氢氧根离子恰好反应且同时生成硫酸钠、硫酸钡; (4)此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中c(Ba2+)是原来的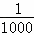 ,但接近中性时要考虑水的电离. ,但接近中性时要考虑水的电离. |
| 解答: | 解:温度T℃下,某Ba(OH)2稀溶液中c(H+)=10﹣amol/L,c(OH﹣)=10﹣bmol/L,a+b=12,c(H+).c(OH﹣)=10﹣12mol/L, (1)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,该温度下c(H+).c(OH﹣)=10﹣12mol/L>10﹣14mol/L,所以该温度大于25℃,故答案为:大于; (2)该温度下,溶液的pH=6时呈中性,①中溶液的pH=8,则Ba(OH)2稀溶液中c(OH﹣)= mol/L=10﹣4mol/L,则b=4,③混合溶液pH=6,说明溶液呈中性,溶液体积相等,则氢离子浓度和氢氧根离子的浓度相等,所以NaHSO4溶液中c(H+)=10﹣4mol/L, mol/L=10﹣4mol/L,则b=4,③混合溶液pH=6,说明溶液呈中性,溶液体积相等,则氢离子浓度和氢氧根离子的浓度相等,所以NaHSO4溶液中c(H+)=10﹣4mol/L, pH=7>6,说明溶液呈碱性,则溶液中 mol/L=10﹣5mol/L, mol/L=10﹣5mol/L, 混合溶液中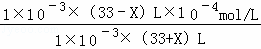 =10﹣5mol/L,X=27, =10﹣5mol/L,X=27, 故答案为,4;27; (3)反应③中氢离子和氢氧根离子恰好反应且同时生成硫酸钠、硫酸钡,离子方程式为Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O,故答案为:Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O; (4)此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中c(Ba2+)是原来的 为5×10﹣8mol/L,但接近中性时要考虑水的电离,溶液中c(OH﹣)=10﹣6mol/L,所以c(Ba2+):c(OH﹣)=5×10﹣8mol/L:10﹣6mol/L=1:20,故答案为:1:20. 为5×10﹣8mol/L,但接近中性时要考虑水的电离,溶液中c(OH﹣)=10﹣6mol/L,所以c(Ba2+):c(OH﹣)=5×10﹣8mol/L:10﹣6mol/L=1:20,故答案为:1:20. |
| 点评: | 本题考查酸碱混合溶液定性判断及溶液pH的计算,正确计算氢氧化钡和硫酸氢钠溶液的物质的量浓度是解本题关键,注意酸或碱稀释接近中性时要考虑水的电离,为易错点,题目难度中等. |
