еңЁ1пҪһ18еҸ·е…ғзҙ дёӯпјҢйғЁеҲҶиҝһз»ӯе…ғзҙ еҚ•иҙЁзҡ„зҶ”зӮ№жғ…еҶөеҰӮдёӢеӣҫжүҖзӨәпјҢиҜ•еӣһзӯ”пјҡ
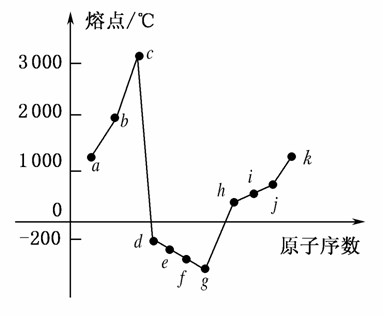
(1)cзӮ№д»ЈиЎЁзҡ„еҚ•иҙЁеҸҜд»ҘжҳҜ________пјҢе…¶зҶ”зӮ№й«ҳзҡ„дё»иҰҒеҺҹеӣ жҳҜ____________________________гҖӮ
(2)dжүҖеұһзҡ„жҷ¶дҪ“зұ»еһӢжҳҜ________гҖӮ
еңЁ1пҪһ18еҸ·е…ғзҙ дёӯпјҢйғЁеҲҶиҝһз»ӯе…ғзҙ еҚ•иҙЁзҡ„зҶ”зӮ№жғ…еҶөеҰӮдёӢеӣҫжүҖзӨәпјҢиҜ•еӣһзӯ”пјҡ

(1)cзӮ№д»ЈиЎЁзҡ„еҚ•иҙЁеҸҜд»ҘжҳҜ________пјҢе…¶зҶ”зӮ№й«ҳзҡ„дё»иҰҒеҺҹеӣ жҳҜ____________________________гҖӮ
(2)dжүҖеұһзҡ„жҷ¶дҪ“зұ»еһӢжҳҜ________гҖӮ
и§ЈжһҗгҖҖз”ұеӣҫеҲҶжһҗcзӮ№зҡ„зҶ”зӮ№еңЁ3 000 в„ғд»ҘдёҠпјҢиҖҢзӣёйӮ»зҡ„dзӮ№зҡ„зҶ”зӮ№еҫҲдҪҺпјҢеҸҜжҺЁзҹҘcе…ғзҙ дёәзўіе…ғзҙ пјҢе…¶еҚ•иҙЁеҸҜиғҪдёәеҺҹеӯҗжҷ¶дҪ“жҲ–ж··еҗҲеһӢжҷ¶дҪ“гҖӮз”ұжӯӨеҸҜзҹҘaпјҚkдҫқж¬ЎдёәBeгҖҒBгҖҒCгҖҒN2гҖҒO2гҖҒF2гҖҒNeгҖҒNaгҖҒMgгҖҒAlгҖҒSiгҖӮcеҚ•иҙЁдёәйҮ‘еҲҡзҹіпјҢд№ҹеҸҜиғҪжҳҜзҹіеўЁ(ж··еҗҲеһӢжҷ¶дҪ“)пјҢйҮ‘еҲҡзҹіжҳҜеҺҹеӯҗжҷ¶дҪ“пјҢзўізўій”®й”®иғҪеҫҲеӨ§пјҢзҶ”зӮ№еҫҲй«ҳ(зҹіеўЁжҳҜж··еҗҲеһӢжҷ¶дҪ“пјҢдҪҶеңЁжҜҸеұӮеҶ…пјҢзўідёҺзўід»ҘжһҒејәзҡ„е…ұд»·й”®зӣёз»“еҗҲпјҢж•…зҶ”зӮ№еҫҲй«ҳ)гҖӮиҖҢdеҚ•иҙЁзҶ”зӮ№дёә0 в„ғпјҢеёёжё©дёӢдёәж°”дҪ“пјҢжҳҜйқһйҮ‘еұһеҚ•иҙЁпјҢеӣ жӯӨжҳҜеҲҶеӯҗжҷ¶дҪ“гҖӮ
зӯ”жЎҲгҖҖ(1)йҮ‘еҲҡзҹіжҲ–зҹіеўЁгҖҖйҮ‘еҲҡзҹіжҳҜеҺҹеӯҗжҷ¶дҪ“пјҢжҷ¶дҪ“дёӯеӯҳеңЁCвҖ”Cе…ұд»·й”®пјҢй”®иғҪеҫҲеӨ§пјҢеӣ жӯӨзҶ”зӮ№еҫҲй«ҳпјҢзҹіеўЁдёәж··еҗҲеһӢжҷ¶дҪ“пјҢеҗҢдёҖеұӮеҶ…еӯҳеңЁCвҖ”Cе…ұд»·й”®пјҢе…ұд»·й”®й”®иғҪжҜ”йҮ‘еҲҡзҹідёӯCвҖ”Cзҡ„й”®иғҪиҝҳеӨ§пјҢзҶ”зӮ№жҜ”йҮ‘еҲҡзҹіиҝҳиҰҒй«ҳ
(2)еҲҶеӯҗжҷ¶дҪ“