A、B、C、D为四种可溶性盐,它们的阳离子分别是Ba2+、Ag+、Na+、Cu2+中的一种,阴离子分别是NO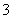 、SO
、SO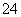 、Cl-、CO
、Cl-、CO 中的一种(离子在物质中不能重复出现)。现做如下实验:
中的一种(离子在物质中不能重复出现)。现做如下实验:
①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色;
②向①的四支试管中分别加入盐酸,B的溶液中有沉淀生成,D的溶液中有无色无味的气体逸出。
根据①②实验现象回答下列问题。
(1)写出A、C的化学式:A__________________________________________________,
C______________________________。
(2)写出盐酸与D反应的离子方程式:_________________________________________。
(3)写出C与Ba(OH)2溶液反应的离子方程式:__________________________________。
【答案】(1)BaCl2 CuSO4;(2)CO +2H+===H2O+CO2↑;(3)Cu2++SO
+2H+===H2O+CO2↑;(3)Cu2++SO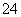 +Ba2++2OH-===BaSO4↓+Cu(OH)2↓
+Ba2++2OH-===BaSO4↓+Cu(OH)2↓
【解析】
试题分析:(1)①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色,则C溶液中的阳离子为Cu2+;②向①的四支试管中分别加入盐酸,B的溶液中有沉淀生成,则B中的阳离子为Ag+,由于B为可溶性盐,因此B为AgNO3;D的溶液中有无色无味的气体逸出,则D中阴离子为CO ,则D为Na2CO3;故C为CuSO4,A为BaCl2;故答案:BaCl2、CuSO4;(2)盐酸与Na2CO3反应有二氧化碳气体放出,反应的离子方程式为:CO
,则D为Na2CO3;故C为CuSO4,A为BaCl2;故答案:BaCl2、CuSO4;(2)盐酸与Na2CO3反应有二氧化碳气体放出,反应的离子方程式为:CO +2H+===H2O+CO2↑;(3) CuSO4与Ba(OH)2溶液反应,生成BaSO4白色沉淀和Cu(OH)2蓝色沉淀,反应的离子方程式为:Cu2++SO
+2H+===H2O+CO2↑;(3) CuSO4与Ba(OH)2溶液反应,生成BaSO4白色沉淀和Cu(OH)2蓝色沉淀,反应的离子方程式为:Cu2++SO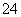 +Ba2++2OH-===BaSO4↓+Cu(OH)2↓。
+Ba2++2OH-===BaSO4↓+Cu(OH)2↓。
考点:考查无机物的推断及离子方程式的书写。
![]() 、SO
、SO![]() 、Cl-、CO
、Cl-、CO![]() 中的一种(离子在物质中不能重复出现)。现做如下实验:
中的一种(离子在物质中不能重复出现)。现做如下实验: