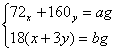实验室可用下列实验装置测定FeO和Fe2O3固体混合物中Fe2O3的质量(图中
实验室可用下列实验装置测定FeO和Fe
2O
3固体混合物中Fe
2O
3的质量(图中夹持装置已略去)。
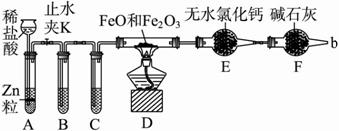
(1)实验前如何检查装置A的气密性 ;对A中所发生的反应,有时要向其中加入少量硫酸铜溶液,目的是 。
(2)为了安全,在点燃酒精灯之前,在F装置出口b处必须 ,实验开始后,在b处必须 。
(3)装置C中所放试剂为浓硫酸,则装置B的作用是 。
(4)干燥管E右边又连接干燥管F的目的是 。若无干燥管F,测得Fe2O3的质量将 (填“偏大”“偏小”或“无影响”)。
(5)若FeO和Fe2O3混合物的质量为a g,反应完全后干燥管E的质量增加了b g,则混合物中Fe2O3的质量为 g(用含字母的数学式表示)。
(1)关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,若液面高度差不发生变化,则气密性良好
加快氢气产生的速
(2)检验氢气的纯度点燃未反应的氢气
(3)除去氢气中混有的氯化氢气体
(4)防止空气中的水蒸气进入干燥管E中偏大
(5)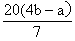
解析:(1)对A气密性的检查用液封法,在Zn+HCl(稀) 中加少量CuSO4溶液,目的是形成原电池可加快反应速率;(2)H2+O2混合点燃会爆炸,即可燃性气体点燃前都必须检验纯度,实验开始后若未反应,H2排入空气也会带来危险,必须处理掉;(3)A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验;(4)干燥管F的作用防空气中水蒸气对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,即氧的含量增大,则FeO与Fe2O3相比较得Fe2O3的质量将偏大。(5)设FeO、Fe2O3物质的量分别为x、y,则
中加少量CuSO4溶液,目的是形成原电池可加快反应速率;(2)H2+O2混合点燃会爆炸,即可燃性气体点燃前都必须检验纯度,实验开始后若未反应,H2排入空气也会带来危险,必须处理掉;(3)A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验;(4)干燥管F的作用防空气中水蒸气对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,即氧的含量增大,则FeO与Fe2O3相比较得Fe2O3的质量将偏大。(5)设FeO、Fe2O3物质的量分别为x、y,则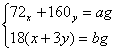
解得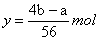 。
。
则Fe2O3的质量为: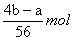 ×160 g·mol-1=
×160 g·mol-1=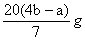 。
。