偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应: (CH3)2
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g) 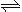 2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
【知识点】原电池原理、化学平衡的移动 F3 G2 H1
【答案解析】(1)N2O4+8e-+8H+=N2+4H2O ; (2)吸热 (3)a,d;不变;0.1 (4)NH4++H2O NH3.H2O+H+
NH3.H2O+H+
逆向;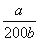
解析:(1)根据原电池得正极发生还原反应,结合酸性电解质,得到正极的电极反应式为: N2O4+8e-+8H+=N2+4H2O ;
(2)温度升高时,气体颜色变深,说明升高温度平衡向正反应方向移动,则反应(Ⅱ)为吸热反应。
(3)恒压密闭容器中,随着反应的进行气体的物质的量增大,容器体积增大,密度减小,当气体密度不变时意味着平衡不再移动,a 图正确,;b.ΔH不变不能作为平衡状态的标志;c.速率减小,c图错误;d.的转化率先增大,不变时说明反应达最大限度说明反应达到平衡状态,d正确;化学平衡常数只与温度有关,所以不变;3s后NO2的物质的量为0.6mol,则0~3s 内的平均反应速率vNO2=0.6mol/(1L·3s)=0.2mol·L-1·s-1 则0~3s内的平均反应速率v(N2O4)=0.1mol·L-1·s-1。
(4)将amol NH4NO3溶于水,溶液显酸性,原因是铵根离子水解:NH4++H2O NH3.H2O+H+
NH3.H2O+H+
原溶液是盐溶液,盐水解促进水的电离,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将逆向移动,
根据电荷守恒式:C(NH4+)+C(H+)=C(OH-)+C(NO3-),溶液呈中性C(NH4+)=C(NO3-),结合电离平衡常数表达式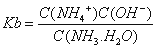 得到所滴加氨水的浓度。
得到所滴加氨水的浓度。
【思路点拨】本题考查了原电池原理、化学平衡的移动等知识,理解化学平衡状态是关键。
![]()
![]() 2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
