常温下,分别向体积相同、浓度均为1 mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lg C)间的关系如图。下列对该过程相关分析正确的是
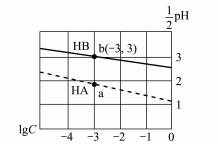
A. HB的电离常数(KA)数量级为10-3
B. 其钠盐的水解常数(Kh)大小关系是:NaB>NaA
C. a、b两点溶液中,水的电离程度b<a
D. 当lg C= -7时,两种酸溶液均有pH=7
常温下,分别向体积相同、浓度均为1 mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lg C)间的关系如图。下列对该过程相关分析正确的是

A. HB的电离常数(KA)数量级为10-3
B. 其钠盐的水解常数(Kh)大小关系是:NaB>NaA
C. a、b两点溶液中,水的电离程度b<a
D. 当lg C= -7时,两种酸溶液均有pH=7
【答案】B
【解析】A. B点,c=10-3mol·L-1,c(H+)=10-6mol·L-1,c(B-)=10-6mol·L-1, HB的电离常数(KA)=10-6×10-6/10-3=10-9,故A错误;B、与A同理,Ka=10-4×10-4/10-3=10-5,HB酸性弱,对应的盐水解能力强,故B正确;C、a、b两点溶液中,b水解程度大,水电离程度大,水的电离程度b>a,故C错误;D、当lg C= -7时,HB中c(H+)=![]() mol·L-1 ,HA中c(H+)=
mol·L-1 ,HA中c(H+)=![]() mol·L-1,pH均不为7,故D错误;故选B。
mol·L-1,pH均不为7,故D错误;故选B。