某学习小组利用氢氧化钙溶液和稀盐酸进行中和反应实验时,忘记滴加酚酞试液,于是他们取反应后的溶液少许于试管中,向其中滴加了几滴酚酞试液,发现试液为无色.根据实验现象,同学们对反应后的溶质成分展开了探究.
【提出问题】反应后的溶质成分是什么?
【查阅资料】CaCl2溶液呈中性.
【提出猜想】甲同学从反应情况分析,溶液中除含少量酚酞外,溶质可能有以下三种情况:①CaCl2;②CaCl2和HCl;③CaCl2和Ca(OH)2
【分析讨论】乙同学从实验现象分析得出:猜想③肯定不合理,其理由是.
【实验探究】丙同学取反应后的溶液倒入烧杯中,向其中逐滴滴加稀碳酸钠溶液至过量,边滴边搅拌.实验后得出产生沉淀质量与滴加碳酸钠溶液体积之间的关系,如图1所示.写出实验过程中的现象 ,
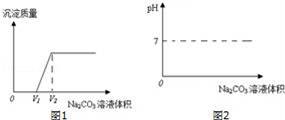

在0﹣V1段中主要发生反应的方程式为 .
【得出结论】甲同学的猜想中, (填序号)合理.
【反思讨论】(1)学习小组结合图象,分析了丙同学实验过程中烧杯内溶液的变化.下列说法正确的是 (填字母).
A.氯化钙的质量先增大后减小 B.氯化钠质量逐渐增大,V2后不变
C.溶液质量逐渐增大 D.Na2CO3溶液体积为V2时,溶液中有NaCl和CaCl2
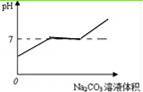
(2)小组同学讨论分析,发现烧杯内溶液的pH随着Na2CO3溶液体积的增加而发生改变,请你在图2中帮他们绘制出随着Na2CO3溶液体积的增加溶液pH的变化图象.
【考点】实验探究物质的组成成分以及含量;酸的化学性质;碱的化学性质;溶液的酸碱性与pH值的关系;书写化学方程式、 ;根据化学反应方程式的计算.
【分析】根据氢氧化钙溶液能与某些非金属氧化物反应生成盐和水解答;
【分析讨论】根据稀盐酸加入滴有酚酞的石灰水中,红色褪为无色,说明溶液为中性或酸性解答;
探究二:根据图示现象分析解答.
【得出结论】根据实验探究得出结论;
【反思讨论】根据碳酸钠和稀盐酸反应,生成氯化钠、水和二氧化碳解答;根据碳酸钠和氯化钙反应,生成碳酸钙沉淀、氯化钠解答.
【解答】解:
【分析讨论】稀盐酸加入滴有酚酞的石灰水中,红色褪为无色,说明溶液为中性或酸性,不可能有氢氧化钙;
探究二:根据图示现象分析可知:因稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,产生气泡,然后再与氯化钙反应,生成的碳酸钙沉淀,溶液最终变红色;在0﹣V1段中主要发生反应的方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O
【得出结论】根据实验探究可知:溶液中除含少量酚酞外,溶质有CaCl2和HCl,故②正确;
【反思讨论】碳酸钠和稀盐酸反应,生成氯化钠、水和二氧化碳;碳酸钠和氯化钙反应,生成碳酸钙沉淀、氯化钠,故:
A、氯化钙的质量逐渐减小,故错;
B、氯化钠质量逐渐增大,V2后反应完全,保持不变,故对;
C、不断滴加碳酸钠溶液,溶液质量逐渐增大,故对;
D、Na2CO3溶液体积为V2时,恰好完全反应,溶液中有NaCl,故错;
(2)因稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,pH<7,然后再与氯化钙反应,生成的碳酸钙沉淀,PH=7,碳酸钠过量,pH>7溶液最终变红色;

答案:
【分析讨论】:稀盐酸加入滴有酚酞的石灰水中,红色褪为无色,说明溶液为中性或酸性,不可能有氢氧化钙;
探究二:滴加碳酸钠溶液,开始先产生气泡,随后才产生沉淀,溶液最终变红色. Na2CO3+2HCl═2NaCl+CO2↑+H2O;
【得出结论】②.
【反思讨论】(1)BC.
(2)