无机化合物A主要用于药物制造.在一定条件下,2.30g固体A与5.35g NH4Cl固体恰好完全反应,生成固体B和4.48L气体C(标准状况).气体C极易溶于水得到碱性溶液,电解无水B可生成一种短周期元素的金属单质D和氯气.由文献资料知道:工业上物质A可用金属D与液态的C在硝酸铁催化下反应来制备A物质,纯净的A物质为白色固体,但制得的粗品往往是灰色的;物质A的熔点390℃,沸点430℃,密度大于苯或甲苯,遇水反应剧烈,也要避免接触酸、酒精.在空气中A缓慢分解,对其加强热则猛烈分解,在750~800℃分解为化合物E和气体C.
回答下列问题:
(1)A的化学式 ,C的电子式为 .
(2)A与盐酸反应的化学方程式为 .
(3)A在750~800℃分解的方程式为 ,制得的粗品往往是灰色的,其可能的原因是 .
(4)久置的A可能大部分变质而不能使用,需要将其销毁.遇到这种情况,可用苯或甲苯将其覆盖,然后缓慢加入用苯或甲苯稀释过的无水乙醇,试解释其化学原理.
.
(5)工业制备单质D的流程图如图:
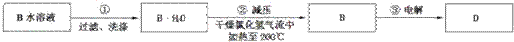
①步骤①中操作名称是 .
②试用平衡移动原理解释步骤②中减压的目的是 .
(6)写出D的重氢化合物与水反应的化学方程式为 .
【答案】(1)LiNH2; ;
;
(2)LiNH2+2HCl=LiCl+NH4Cl;
(3)3LiNH2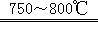 Li3N+2NH3 ;制得的产物中含有杂质铁;
Li3N+2NH3 ;制得的产物中含有杂质铁;
(4)LiNH2密度大于苯或甲苯且不溶于它们,所以可用苯或甲苯进行覆盖;乙醇羟基上的氢较活泼,故也可以跟LiNH2反应,方程式为LiNH2+C2H5OH﹣→C2H5OLi+NH3,但是由于醇羟基上的氢比水中氢不活泼,故此反应进行较缓慢,可将其销毁又不会有危险.
(5)① 蒸发浓缩、冷却结晶;
② 存在平衡:LiCl·H2O(s) LiCl(s)+H2O(g),减小压强,有利于平衡向正方向移动,有利于无水LiCl的制备;
LiCl(s)+H2O(g),减小压强,有利于平衡向正方向移动,有利于无水LiCl的制备;
(6)LiD+H2O=LiOH+HD↑.
【解析】(1)在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C (标准状况),气体C极易溶于水得到碱性溶液,可推知C为NH3,电解无水B可生成一种短周期元素的金属单质D和氯气,B为金属D氯化物,4.48L氨气的物质的量=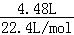 =0.2mol,其质量=0.2mol×17g/mol=3.4g,根据质量守恒可知B的质量为2.3g+5.35g﹣3.4g=4.25g,NH4Cl的摩尔质量为53.5g/mol,5.35gNH4Cl为0.1mol,若D为ⅡA族金属,则固体A与NH4Cl固体反应可表为:A+NH4Cl→DCl2+NH3,根据Cl原子守恒,DCl2的物质的量=0.05mol,其摩尔质量=
=0.2mol,其质量=0.2mol×17g/mol=3.4g,根据质量守恒可知B的质量为2.3g+5.35g﹣3.4g=4.25g,NH4Cl的摩尔质量为53.5g/mol,5.35gNH4Cl为0.1mol,若D为ⅡA族金属,则固体A与NH4Cl固体反应可表为:A+NH4Cl→DCl2+NH3,根据Cl原子守恒,DCl2的物质的量=0.05mol,其摩尔质量=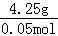 =85g/mol,D的相对分子质量=85﹣71=14,不符合题意,若D为ⅠA族金属,则固体A与NH4Cl固体反应可表为:A+NH4Cl→DCl+NH3,根据Cl原子守恒,DCl的物质的量=0.1mol,其摩尔质量=
=85g/mol,D的相对分子质量=85﹣71=14,不符合题意,若D为ⅠA族金属,则固体A与NH4Cl固体反应可表为:A+NH4Cl→DCl+NH3,根据Cl原子守恒,DCl的物质的量=0.1mol,其摩尔质量=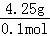 =42.5g/mol,D的相对分子质量=42.5﹣35.5=7,故D为Li,可推知B为LiCl,那么2.3g化合物A中含Li元素也为 0.1mol,再根据质量守恒和原子守恒(原子的种类和数目反应前后相同),则2.3gA中含有N原子为0.2mol﹣0.1mol=0.1mol,含有H原子为0.2mol×4﹣0.4mol=0.2mol,可推知A是LiNH2,氨气的电子式为:
=42.5g/mol,D的相对分子质量=42.5﹣35.5=7,故D为Li,可推知B为LiCl,那么2.3g化合物A中含Li元素也为 0.1mol,再根据质量守恒和原子守恒(原子的种类和数目反应前后相同),则2.3gA中含有N原子为0.2mol﹣0.1mol=0.1mol,含有H原子为0.2mol×4﹣0.4mol=0.2mol,可推知A是LiNH2,氨气的电子式为: ,
,
故答案为:LiNH2; ;
;
(2)根据化合物A(LiNH2)遇水强烈水解,能生成LiOH和NH3,所以其与盐酸反应生成LiCl、NH4Cl,反应方程式为:LiNH2+2HCl=LiCl+NH4Cl,
故答案为:LiNH2+2HCl=LiCl+NH4Cl;
(3)LiNH2中N原子与H原子数目之比为1:2,NH3中N原子与H原子数目之比为1:3,故化合物E含有Li、N元素,应为Li3N,反应方程式为:3LiNH2 Li3N+2NH3 ;制得的产物中含有杂质铁,使粗品往往是灰色,
Li3N+2NH3 ;制得的产物中含有杂质铁,使粗品往往是灰色,
故答案为:3LiNH2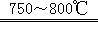 Li3N+2NH3 ;制得的产物中含有杂质铁;
Li3N+2NH3 ;制得的产物中含有杂质铁;
(4)LiNH2密度大于苯或甲苯且不溶于它们,所以可用苯或甲苯进行覆盖;乙醇羟基上的氢较活泼,故也可以跟LiNH2反应,方程式为LiNH2+C2H5OH﹣→C2H5OLi+NH3,但是由于醇羟基上的氢比水中氢不活泼,故此反应进行较缓慢,可将其销毁又不会有危险,
故答案为:LiNH2密度大于苯或甲苯且不溶于它们,所以可用苯或甲苯进行覆盖;乙醇羟基上的氢较活泼,故也可以跟LiNH2反应,方程式为LiNH2+C2H5OH﹣→C2H5OLi+NH3,但是由于醇羟基上的氢比水中氢不活泼,故此反应进行较缓慢,可将其销毁又不会有危险.
(5)通过工业制备单质Li的流程图可知:步骤①是要从LiCl溶液获得LiCl﹒H2O晶体,所以,其操作应为:蒸发浓缩、冷却结晶、过滤、洗涤.步骤②是要将LiCl﹒H2O晶体在减压、干燥的氯化氢气氛中加热(200℃)生成无水LiCl,然后经步骤③电解熔融的LiCl制得金属Li,则:
①步骤①中的操作己经有过滤、洗涤,还应有“蒸发浓缩、冷却结晶”,
故答案为:蒸发浓缩、冷却结晶;
②LiCl·H2O晶体脱去结晶水生成无水LiCl的反应:LiCl·H2O(s) LiCl (s)+H2O(g),是一个扩大气体体积的反应,所以减小压强,有利于平衡LiCl·H2O(s)
LiCl (s)+H2O(g),是一个扩大气体体积的反应,所以减小压强,有利于平衡LiCl·H2O(s) LiCl (s)+H2O(g),向正方向移动,有利于无水LiCl的制备.
LiCl (s)+H2O(g),向正方向移动,有利于无水LiCl的制备.
故答案为:存在平衡:LiCl·H2O(s) LiCl(s)+H2O(g),减小压强,有利于平衡向正方向移动,有利于无水LiCl的制备;
LiCl(s)+H2O(g),减小压强,有利于平衡向正方向移动,有利于无水LiCl的制备;
(6)LiD中阳离子与水电离的氢氧根离子结合,而阳离子与水电离的氢离子结合,反应方程式为:LiD+H2O=LiOH+HD↑,
故答案为:LiD+H2O=LiOH+HD↑.
![]()
