以磷石膏(![]() 主要成分CaSO4,杂质SiO2、
主要成分CaSO4,杂质SiO2、
Al2O3等)为原料可制备轻质CaCO3。
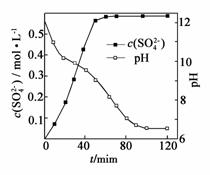
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO![]() )随时间变化如图。清液pH>11时CaSO4转化的离子方程式为________;能提高其转化速率的措施有________(填序号)。
)随时间变化如图。清液pH>11时CaSO4转化的离子方程式为________;能提高其转化速率的措施有________(填序号)。
A.搅拌浆料 ![]() B.加热浆料至100 ℃
B.加热浆料至100 ℃
C.增大氨水浓度 D.减小CO2通入速率
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为_______![]() _和________(填化学式);检验洗涤是否完全的方法是_________________________________________________。
_和________(填化学式);检验洗涤是否完全的方法是_________________________________________________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因是___________________________
________________________________________![]() ___________________。
___________________。
