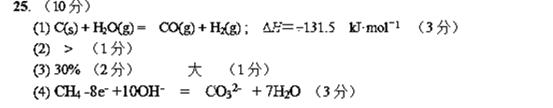(1) )已知:C(s) + O2(g) ![]() CO2(g) ΔH=-437.3 kJ•mol-1
CO2(g) ΔH=-437.3 kJ•mol-1
![]() H2(g) + O2(g)
H2(g) + O2(g) ![]() H2O(g) ΔH=-285.8 kJ•mol-1
H2O(g) ΔH=-285.8 kJ•mol-1
CO(g) + O2(g) ![]() CO2(g) ΔH=-283.0 kJ•mol-1
CO2(g) ΔH=-283.0 kJ•mol-1
则固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是
(2) 我国实施“嫦娥探月”行动的长征火箭中使用偏二甲肼[(CH3)2N—NH2]作为燃料,其与过氧化氢发生反应放出大量热量C2H8N2(l)+8H2O2(l)===N2(g)+2CO2(g)+12H2O(g) ΔH=-2 500 kJ/mol。如果1 mol偏二甲肼与过氧化氢发生上述反应生成液态水,则反应中放出的热量Q______2 500 kJ(填“<”、“>”或“=”)。
(3)恒温恒容下, 2 mol H2与2 mol N2反应达到平衡时,N2为1.8 mol,H2的转化率为________;若该反应在恒温恒压条件下进行(其他条件相同),反应达平衡时,H2的转化率比上述条件下H2的转化率________(填“大”、“小”或“相等”)。
(4)由甲烷、氧气和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为________________ 。