еңЁй…ёжҖ§д»ӢиҙЁдёӯпјҢеҗ‘MnSO4жә¶ж¶Ідёӯж»ҙеҠ пјҲNH4пјү2S2O8пјҲиҝҮдәҢзЎ«й…ёй“өпјүжә¶ж¶Ідјҡ
еңЁй…ёжҖ§д»ӢиҙЁдёӯпјҢеҗ‘MnSO4жә¶ж¶Ідёӯж»ҙеҠ пјҲNH4пјү2S2O8пјҲиҝҮдәҢзЎ«й…ёй“өпјүжә¶ж¶ІдјҡеҸ‘з”ҹеҰӮдёӢзҰ»еӯҗеҸҚеә”пјҡ2Mn2++5 S2O82-+8X=2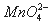 +10 SO42-+16H+пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
+10 SO42-+16H+пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
В В AпјҺXжҳҜH2O
В В BпјҺиҝҳеҺҹжҖ§пјҡSO42-> Mn2+
В В В В CпјҺиҜҘеҸҚеә”дёӯй…ёжҖ§д»ӢиҙЁеҸҜд»Ҙдёәзӣҗй…ё
В В DпјҺжҜҸз”ҹжҲҗ0.1mol SO42-пјҢиҪ¬з§»з”өеӯҗ0.05mol
гҖҗзҹҘиҜҶзӮ№гҖ‘ж°§еҢ–иҝҳеҺҹеҸҚеә”В В B2В В B3
гҖҗзӯ”жЎҲи§ЈжһҗгҖ‘AВ и§ЈжһҗпјҡAгҖҒж №жҚ®з”өиҚ·е®ҲжҒ’е’ҢиҙЁйҮҸе®ҲжҒ’еҲӨж–ӯXжҳҜH2OпјҢж•…AжӯЈзЎ®пјӣBгҖҒж №жҚ®иҝҳеҺҹеүӮзҡ„иҝҳеҺҹжҖ§ејәдәҺиҝҳеҺҹдә§зү©пјҢиҝҳеҺҹжҖ§еә”иҜҘжҳҜMn2+> SO42-пјҢж•…Bй”ҷиҜҜпјӣCгҖҒиҜҘеҸҚеә”дёӯй…ёжҖ§д»ӢиҙЁеҰӮжһңдёәзӣҗй…ёпјҢе°ұдјҡеҸ‘з”ҹпјҲNH4пјү2S2O8дёҺзӣҗй…ёзҡ„ж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢжүҖд»ҘиҜҘеҸҚеә”дёӯй…ёжҖ§д»ӢиҙЁдёҚиғҪдёәзӣҗй…ёпјҢж•…Cй”ҷиҜҜпјӣDгҖҒиҪ¬з§»з”өеӯҗеҲҶжһҗй”ҷиҜҜгҖӮ
ж•…зӯ”жЎҲйҖүA
гҖҗжҖқи·ҜзӮ№жӢЁгҖ‘жң¬йўҳиҖғжҹҘдәҶж°§еҢ–иҝҳеҺҹеҸҚеә”规еҫӢпјҢDйҖүйЎ№з”ұдәҺжІЎз»ҷпјҲNH4пјү2S2O8зҡ„з»“жһ„пјҢжүҖд»ҘиҪ¬з§»з”өеӯҗж•°йҡҫеҲҶжһҗпјҢеҒҡдёәеҚ•йҖүйўҳе·Із»Ҹй”Ғе®ҡAйҖүйЎ№пјҢе°ұдёҚиҰҒеңЁиҝҷдёҖйҖүйЎ№дёҠдёӢеҠҹеӨ«гҖӮ
![]() +10 SO42-+16H+пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
+10 SO42-+16H+пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ