(1)NO的体积为___________L,NO2的体积为___________L。
(2)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸物质的量浓度为___________ mol·L-1。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水___________g。
(1)NO的体积为___________L,NO2的体积为___________L。
(2)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸物质的量浓度为___________ mol·L-1。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水___________g。
(1)5.8 5.4
(2)![]() (3)57.7
(3)57.7
解析:(1)设生成NO的体积为x、NO2的体积为y,可建立方程:x+y=11.2 L。再由得失电子守恒知:Cu失去的电子数等于NO和NO2得到的电子数,又可建立方程:
![]() ×1,联立方程组可解得:x=5.8 L,y=5.4 L。
×1,联立方程组可解得:x=5.8 L,y=5.4 L。
(2)根据原硝酸中氮元素守恒:N最终以NO、NO2混合气体,NaNO3及剩余的HNO3形式存在于溶液中。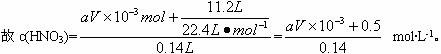
(3)H2O2作氧化剂,NO、NO2混合气体作还原剂,仍依据得失电子守恒可得:
![]() ×[(-1)-(-2)]×2=
×[(-1)-(-2)]×2=![]() ×[(+5)-(+2)]+
×[(+5)-(+2)]+![]() ×[(+5)-(+4)],解得m(H2O2)=57.7 g。
×[(+5)-(+4)],解得m(H2O2)=57.7 g。