化学兴趣小组的同学取10g铜锌合金样品于烧杯中,向其中加入一定量的稀硫酸,当加入稀硫酸的质量为93.7g时,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:
(1)样品中锌的质量为 g.
(2)反应后,所得溶液中溶质的质量分数为多少?
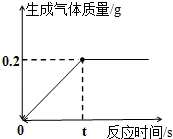
化学兴趣小组的同学取10g铜锌合金样品于烧杯中,向其中加入一定量的稀硫酸,当加入稀硫酸的质量为93.7g时,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:
(1)样品中锌的质量为 g.
(2)反应后,所得溶液中溶质的质量分数为多少?

【考点】根据化学反应方程式的计算;有关溶质质量分数的简单计算.
【专题】溶质质量分数与化学方程式相结合的计算;综合计算(图像型、表格型、情景型计算题).
【分析】由图中数据可知生成氢气的质量,根据氢气的质量可以计算锌和生成硫酸锌的质量,进一步可以计算溶液中硫酸锌的质量分数.
【解答】解:(1)由图可知完全反应后生成氢气的质量为0.2g,
设锌的质量为x,生成硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2![]()
x y 0.2g
![]() =
=![]() =
=![]()
解得:x=6.5g y=16.1g
(2)反应后所得溶液中溶质的质量分数为:![]() ×100%=16.1%
×100%=16.1%
答:反应后,所得溶液中溶质的质量分数为16.1%.
故答案为:(1)6.5
(2)16.1%
【点评】本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.