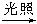某课外兴趣小组利用如下装置探究甲烷与氯气的反应。根据题意,回答下列问题:
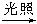
(1)反应前,量筒中CH4与Cl2的体积比为_____________,向100 mL量筒中充入CH4、Cl2的方法是_____________。
(2)CH4与Cl2发生反应的条件是___________;若用日光直射,可能会引起___________。
(3)实验中可观察到的实验现象有:量筒内壁上出现油状液滴,饱和食盐水中有少量固体析出,_____________,_____________等。
(4)实验中生成的油状液滴的化学式为_____________,其中_____________是工业上重要的溶剂。
(5)饱和食盐水中有少量固体析出,其原因是_____________________________________。
(6)用饱和食盐水而不用水的原因是___________________________________________。
(1)1∶4 用排饱和食盐水的方法,先后收集20 mLCH4和80 mLCl2
(2)光照(或光亮处) 爆炸
(3)量筒内黄绿色气体颜色变浅 量筒内液面上升
(4)CH2Cl2、CHCl3、CCl4 CHCl3、CCl4
(5)反应中有HCl生成,使溶液中的Cl-浓度增大,促使NaCl的溶解平衡向生成NaCl固体的方向移动
(6)降低Cl2在水中的溶解度,抑制Cl2和水的反应
解析:(1)问,CH4与Cl2完全反应的化学方程式为CH4+4Cl2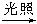
CCl
4+4HCl,则反应前量筒中CH
4与Cl
2的体积比为1∶4,充入方法是:用排饱和食盐水法先后收集20 mLCH
4和80 mLCl
2。(2)问,CH
4与Cl
2反应的条件是光照,日光直射时会引起爆炸。(3)问,反应中Cl
2的逐渐消耗使黄绿色变浅,CH
4和Cl
2的消耗使气体压强减小,量筒内的液面上升。(4)问,CH
4 和Cl
2反应生成的CH
2Cl
2、CHCl
3、CCl
4都是油状液体,其中的CHCl
3和CCl
4是工业上重要的溶剂。(5)问,饱和食盐水中存在NaCl(S)
Na
++Cl
-,随着HCl的生成,溶液中c(Cl
-)不断增大,促使NaCl的溶解平衡向生成NaCl固体的方向移动,导致饱和食盐水中有少量固体析出。(6)问,Cl
2溶于水发生反应Cl
2+H
2O
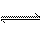
H
++Cl
-+HClO,饱和食盐水中浓度较大的Cl
-使上述平衡左移,从而抑制了Cl
2和H
2O的反应,降低了Cl
2在水中的溶解度。