й“қеңҹзҹҝзҡ„дё»иҰҒжҲҗеҲҶжҳҜAl2O3пјҢеҗ«жңүжқӮиҙЁSiO2гҖҒFe2O3гҖӮе·ҘдёҡдёҠд»Һй“қеңҹзҹҝдёӯжҸҗеҸ–AlеҸҜйҮҮз”ЁеҰӮеӣҫжүҖзӨәе·ҘиүәжөҒзЁӢпјҡ
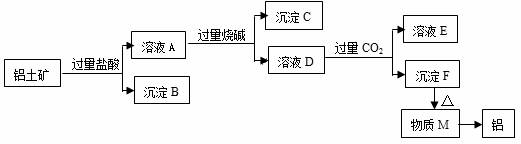
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
пјҲ1пјүжә¶ж¶ІAдёӯеҗ«жңүзҡ„йҳізҰ»еӯҗжңүгҖӮ
пјҲ2пјүжІүж·ҖBдёҺзғ§зўұеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
пјҲ3пјүжә¶ж¶ІDдёӯйҖҡе…ҘиҝҮйҮҸCO2еҸ‘з”ҹеҸҚеә”з”ҹжҲҗжІүж·Җзҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
пјҲ4пјүвҖңйҖҡе…ҘиҝҮйҮҸCO2вҖқиғҪеҗҰж”№з”ЁиҝҮйҮҸзӣҗй…ёпјҢеҺҹеӣ жҳҜгҖӮ
пјҲ5пјүжә¶ж¶ІEдёӯжә¶иҙЁзҡ„дё»иҰҒжҲҗд»ҪжңүпјҲеЎ«еҢ–еӯҰејҸпјүгҖӮ
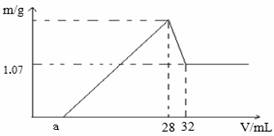 пјҲ6пјүеҗ‘Aжә¶ж¶Ідёӯж»ҙе…Ҙ3mol/L NaOHжә¶ж¶ІпјҢз”ҹжҲҗжІүж·Җзҡ„иҙЁйҮҸдёҺеҠ е…ҘNaOHжә¶ж¶Ізҡ„дҪ“з§Ҝе…ізі»еҰӮеӣҫгҖӮеҲҷжә¶ж¶ІдёӯAl3+зү©иҙЁзҡ„йҮҸдёәгҖҖmolпјҢa=гҖҖгҖҖгҖӮ
пјҲ6пјүеҗ‘Aжә¶ж¶Ідёӯж»ҙе…Ҙ3mol/L NaOHжә¶ж¶ІпјҢз”ҹжҲҗжІүж·Җзҡ„иҙЁйҮҸдёҺеҠ е…ҘNaOHжә¶ж¶Ізҡ„дҪ“з§Ҝе…ізі»еҰӮеӣҫгҖӮеҲҷжә¶ж¶ІдёӯAl3+зү©иҙЁзҡ„йҮҸдёәгҖҖmolпјҢa=гҖҖгҖҖгҖӮ
пјҲ1пјү H+гҖҒAl3+гҖҒFe 3+пјҲ2еҲҶпјҢеҸӘзӯ”еҜ№1з§ҚдёҚз»ҷеҲҶпјҢзӯ”еҜ№2з§Қз»ҷ1еҲҶпјү
пјҲ2пјүSiO2 + 2OH-=== SiO32- + H2OВ пјҲ2еҲҶпјҢдёҚй…Қе№із»ҷ1еҲҶпјү
пјҲ3пјүAlO2- + CO2 + 2H2O === Al(OH)3вҶ“+ HCO3-В В В В В В В В В В В В В пјҲ2еҲҶпјҢдёҚй…Қе№із»ҷ1еҲҶпјү
пјҲ4пјүдёҚиғҪпјҲ1еҲҶпјүВ В В Al(OH)3жІүж·Җдјҡжә¶дәҺиҝҮйҮҸзҡ„зӣҗй…ёдёӯпјҲ2еҲҶпјү
пјҲ5пјүNaHCO3гҖҒNaClВ В В В В В В В В В В В пјҲ2еҲҶпјҢзӯ”еҜ№дёҖз§Қз»ҷ1еҲҶпјү
пјҲ6пјү0.012пјҲ2еҲҶпјүгҖҖ6В пјҲ2еҲҶпјү
гҖҗиҖғзӮ№гҖ‘й“қгҖҒй“ҒгҖҒзЎ…зҡ„еҢ–еҗҲзү©зҡ„жҖ§иҙЁгҖҒиҪ¬еҢ–еҸҠи®Ўз®—
гҖҗи§ЈжһҗгҖ‘й“қеңҹзҹҝдёӯеҗ«жңүAl2O3гҖҒSiO2е’ҢFe2O3пјҢеҠ е…ҘиҝҮйҮҸзӣҗй…ёж—¶пјҢAl2O3е’ҢFe2O3дёҺзӣҗй…ёеҸҚеә”з”ҹжҲҗAl3+е’ҢFe 3+пјҢжүҖд»ҘпјҲ1пјүжә¶ж¶ІA дёӯеҗ«жңүйҳізҰ»еӯҗжҳҜH+гҖҒAl3+гҖҒFe 3+пјҢSiO2дёҚеҸҚеә”пјҢжІүж·ҖBжҳҜSiO2пјӣпјҲ2пјүBдёҺзғ§зўұеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәSiO2 + 2OH- = SiO32- + H2Oпјӣ
пјҲ3пјүжә¶ж¶ІAдёӯH+гҖҒAl3+гҖҒFe 3+дёҺиҝҮйҮҸзғ§зўұеҸҚеә”ж—¶пјҢдҫқж¬Ўз”ҹжҲҗж°ҙгҖҒеҒҸй“қй…ёж №гҖҒж°ўж°§еҢ–й“ҒпјҢжә¶ж¶ІDдёӯдё»иҰҒжҳҜж°ўж°§ж №зҰ»еӯҗе’ҢеҒҸй“қй…ёж №зҰ»еӯҗпјҢйҖҡе…ҘиҝҮйҮҸCO2еҸ‘з”ҹеҸҚеә”з”ҹжҲҗжІүж·Җзҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜпјҡAlO2- + CO2 + 2H2O === Al(OH)3вҶ“+ HCO3- пјӣ
пјҲ4пјүеӣ дёәAl(OH)3жІүж·Җдјҡжә¶дәҺиҝҮйҮҸзҡ„зӣҗй…ёдёӯжүҖд»ҘдёҚиғҪз”ЁиҝҮйҮҸзӣҗй…ёд»ЈжӣҝдәҢж°§еҢ–зўіпјӣ
пјҲ5пјүD дёӯйҷӨжңүж°ўж°§ж №зҰ»еӯҗгҖҒеҒҸй“қй…ёж №зҰ»еӯҗеӨ–пјҢиҝҳжңүеҠ е…Ҙзҡ„й’ зҰ»еӯҗе’Ңж°ҜзҰ»еӯҗпјҢжүҖд»Ҙжә¶ж¶ІEдёӯжә¶иҙЁзҡ„дё»иҰҒжҲҗд»ҪжңүNaHCO3гҖҒNaClпјӣ
пјҲ6пјүеҗ‘Aжә¶ж¶ІпјҲеҗ«H+гҖҒAl3+гҖҒFe 3+пјүдёӯж»ҙе…Ҙ3mol/L NaOHжә¶ж¶ІпјҢд»ҺеӣҫдёӯеҸҜд»ҘзҹҘйҒ“пјҡж°ўж°§еҢ–й“ҒжІүж·Җ1.07gпјҢж°ўж°§еҢ–й“Ғзҡ„зү©иҙЁзҡ„йҮҸдёәпјҡ1.07g/107(g/mol)пјқ0.01molпјҢж°ўж°§еҢ–й“қжә¶и§Јз”ЁеҺ»ж°ўж°§еҢ–й’ жә¶ж¶І4 mLпјҢn(NaOH)=0.004LГ—3mol/пј¬=0.012molпјҢеҚіжә¶и§Јзҡ„ж°ўж°§еҢ–й“қд№ҹдёә0.012molпјҢз”ҹжҲҗ0.012molж°ўж°§еҢ–й“қе’Ң0.01molж°ўж°§еҢ–й“Ғж—¶е…ұж¶ҲиҖ—зҡ„ж°ўж°§еҢ–й’ зү©иҙЁзҡ„йҮҸдёәпјҲ0.036+0.03пјүmolпјқ0.066пјҢдҪ“з§Ҝдёә0.066mol/3пјҲmol/Lпјү=0.022пј¬=22 mLпјҢa=28-22=6

 пјҲ6пјүеҗ‘Aжә¶ж¶Ідёӯж»ҙе…Ҙ3mol/L NaOHжә¶ж¶ІпјҢз”ҹжҲҗжІүж·Җзҡ„иҙЁйҮҸдёҺеҠ е…ҘNaOHжә¶ж¶Ізҡ„дҪ“з§Ҝе…ізі»еҰӮеӣҫгҖӮеҲҷжә¶ж¶ІдёӯAl3+зү©иҙЁзҡ„йҮҸдёәгҖҖmolпјҢa=гҖҖгҖҖгҖӮ
пјҲ6пјүеҗ‘Aжә¶ж¶Ідёӯж»ҙе…Ҙ3mol/L NaOHжә¶ж¶ІпјҢз”ҹжҲҗжІүж·Җзҡ„иҙЁйҮҸдёҺеҠ е…ҘNaOHжә¶ж¶Ізҡ„дҪ“з§Ҝе…ізі»еҰӮеӣҫгҖӮеҲҷжә¶ж¶ІдёӯAl3+зү©иҙЁзҡ„йҮҸдёәгҖҖmolпјҢa=гҖҖгҖҖгҖӮ