硫酸锌片用于治疗食欲不振、发育不良等症状,实验室可用锌和稀硫酸反应制得.
(1)小组同学在老师的指导下,配制200g溶质质量分数为9.8%的稀硫酸.
①用98%的浓硫酸配制200g 溶质质量分数为9.8%的稀硫酸,需加水 g.
②将配制好的稀硫酸转移到试剂瓶中,贴上标签,标签上不必注明的是 (填序号). A.200g B.9.8% C.稀硫酸
③下列操作中的 AC (填序号),可能会导致配制的溶液的溶质的质量分数低于9.8%.
A.量取浓硫酸后,置于空气中时间过长
B.量水时,俯视量筒刻度
C.配制前将烧杯用水冲洗干净,没有擦干
(2)化学兴趣小组的同学取一块表面严重氧化的锌片7.3g(表面只含氧化锌,不含其它杂质),向其中慢慢
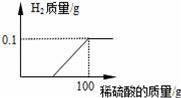
滴加9.8%的稀硫酸,至恰好完全反应时,用去稀硫酸100g,并绘出右图所示的图象.小组同学将反应后
的溶液经一系列操作,得到硫酸锌固体16.1g.
①该锌片中单质锌消耗稀硫酸溶液的质量为多少克?(写出计算过程)该锌片没有氧化前的质量是 g.(不需计算过程,直接写出答案)

【考点】根据化学反应方程式的计算;一定溶质质量分数的溶液的配制;用水稀释改变浓度的方法.
【分析】(1)①根据溶液稀释前后溶质质量相等进行分析;
②根据试剂瓶上需要注明药品的名称和溶质质量分数进行分析;
③根据导致配制的溶液的溶质的质量分数低于9.8%的可能原因是溶质少了或溶剂多了进行分析;
(2)根据锌和硫酸反应生成硫酸锌和氢气,依据氢气的质量进行计算;
(3)根据消耗的硫酸和题中的图象进行计算.
【解答】解:(1)①用98%的浓硫酸配制200g9.8%的稀硫酸,需加水的质量为:200g﹣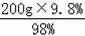
 =180g;
=180g;
②试剂瓶上需要注明药品的名称和溶质质量分数,标签上不必注明的是药品的质量,故选:A;
③导致配制的溶液的溶质的质量分数低于9.8%的可能原因是溶质少了或溶剂多了,
A、量取浓硫酸后,置于空气中时间过长,导致浓硫酸的质量减少了,所以溶质质量分数偏低,故A正确;
B、量水时,俯视量筒刻度,水的体积少了,导致溶质质量分数偏大,故B错误
C、配制前将烧杯用水冲洗干净,没有擦干,导致溶剂的质量多了,所以溶质质量分数偏低,故C正确,
故选:AC;
(2)设生成0.1g氢气消耗的稀硫酸的质量是x
Zn+H2SO4=ZnSO4+H2↑
98 2
x×9.8% 0.1g
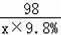
 =
=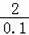

x=50g
(3)锌和硫酸反应生成硫酸锌和氢气,氧化锌和硫酸反应生成硫酸锌和水,所以依据硫酸根离子守恒可知
设该锌片没有氧化前的质量是y
Zn﹣﹣﹣﹣﹣﹣﹣﹣H2SO4,
65 98
y 100g×9.8%
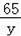
 =
=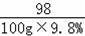

y=6.5g
故答案为:(1)①180g;
②A;
③AC;
(2)50g;
(3)6.5.
【点评】本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.


