铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是工业上从铝土矿(主要成分是Al2O3,含有少量SiO2、Fe2O3等杂质)中生产铝的工艺流程:

据此回答下列问题:
(1)电解制取铝的化学反应中,反应物的键能之和_____生成物的键能之和(填“大于”、“小于”或“等于”)。
(2)铝土矿中绝大部分成分都可以溶解在NaOH溶液中。请根据周期表对角线规则写出铍的氧化物与NaOH溶液反应的离子方程式:______________。
(3)滤渣A的主要成分____________。
(4)在工艺流程第三步中,通入过量二氧化碳所发生反应的化学方程式_______________。
(5)某同学在实验室模拟工业生产铝,称取ag铝土矿可制得bgAl(儇设每步反应进行完全),则铝土矿中Al2O3的质量分数为____________。
【答案】 (1).大于 (2).BeO+2OH-= BeO22-+ H2O (3).Fe2O3 (4).NaAlO2+CO2+2H2O= AlOH)3↓+ NaHCO3 (5).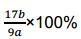
 -+2CO2+2H2O=H2SiO3↓+2HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;(5)题目中,每步反应进行完全,因此根据铝元素守恒,即n(Al2O3)=b/54mol,因此m(Al2O3)=102b/54mol=17b/9mol,其质量分数为
-+2CO2+2H2O=H2SiO3↓+2HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;(5)题目中,每步反应进行完全,因此根据铝元素守恒,即n(Al2O3)=b/54mol,因此m(Al2O3)=102b/54mol=17b/9mol,其质量分数为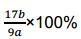 。
。
【点睛】化学工艺流程应分析清楚每步的目的,溶解过程:加入了氢氧化钠溶液,能与NaOH溶液反应的物质,转变成离子,即Al203转变成Al3+,SiO2转变成SiO32-,Fe2O3因不与氢氧化钠反应,作为滤渣除去,酸化:此过程中通入CO2,李彤碳酸的酸性强于硅酸和偏铝酸,分别得到H2SiO3和Al(OH)3,注意是过量CO2,因此生成HCO3-,灼烧:转化成Al2O3和SiO2,电解过程:因为SiO2不导电,不参与电解,即得到金属铝单质。


