工业上处理含
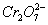
的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)
3和Fe(OH)
3沉淀产生;③过滤回收沉淀,废水达到排放标准。试完成下列问题:
(1)电解时的电极反应:阳极__________________,阴极_____________________。
(2)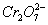
转变成Cr
3+的离子反应方程式:_______________________________________。
(3)电解过程Cr(OH)3、Fe(OH)3沉淀是怎么产生的?________________________________
_____________________________________________________________________。
(4)能否用Cu电极来代替Fe电极?_______,(填“能”或“不能”),简述理由____________
_____________________________________________________________________。
(1)Fe-2e-====Fe2+
2H++2e-====H2↑
(2)6Fe2++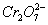 +14H+====6Fe3++2Cr3++7H2O
+14H+====6Fe3++2Cr3++7H2O
(3)在阴极反应及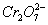 与Fe2+反应过程中,将消耗大量的H+,使溶液pH上升,促使Fe3+、Cr3+水解并最终转化为Fe(OH)3、Cr(OH)3沉淀
与Fe2+反应过程中,将消耗大量的H+,使溶液pH上升,促使Fe3+、Cr3+水解并最终转化为Fe(OH)3、Cr(OH)3沉淀
(4)不能 因为阳极产生的Cu2+不能使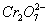 还原到低价
还原到低价
解析:由于Cr(Ⅵ)的化合物毒性远高于Cr(Ⅲ)化合物,将Cr(Ⅵ)转化为Cr(Ⅲ),对废水进行处理是电化学知识在实际生活中的具体运用。在处理有关问题时,应注意思维的有序性:首先应考虑溶液中,阴阳离子在外电场作用下的定向迁移;然后再考虑阴阳两极按放电顺序可能发生的电极方程式。阴极:2H++2e-====H2↑,阳极:Fe-2e-====Fe2+,产生的Fe2+在向阴极迁移的过程中与向阳极迁移的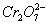 相遇,发生氧化还原反应:6Fe2++
相遇,发生氧化还原反应:6Fe2++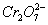 +14H+====6Fe3++2Cr3++7H2O。使
+14H+====6Fe3++2Cr3++7H2O。使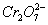 转化为Cr3+,同时Fe2+也转化为Fe3+,在以上电解的阴极反应及Fe2+与
转化为Cr3+,同时Fe2+也转化为Fe3+,在以上电解的阴极反应及Fe2+与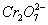 的氧化还原反应中都消耗了大量的H+,溶液的pH不断变大,有利于Fe3+、Cr3+生成相应的Fe(OH)3、Cr(OH)3沉淀。若将Fe电极改成为Cu电极,由于产生的Cu2+不具有还原性,不能将
的氧化还原反应中都消耗了大量的H+,溶液的pH不断变大,有利于Fe3+、Cr3+生成相应的Fe(OH)3、Cr(OH)3沉淀。若将Fe电极改成为Cu电极,由于产生的Cu2+不具有还原性,不能将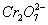 转化为毒性较低的Cr3+,显然是不行的。
转化为毒性较低的Cr3+,显然是不行的。
在实际解题过程中,有许多同学会根据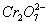 的氧化性强于H+,简单地将阴极反应当作是
的氧化性强于H+,简单地将阴极反应当作是 得电子,这就会导致以后对试题中相关问题的处理含糊不清。这主要是没有将电解过程中的几个不同层次的问题有序地加以分析和处理所致。
得电子,这就会导致以后对试题中相关问题的处理含糊不清。这主要是没有将电解过程中的几个不同层次的问题有序地加以分析和处理所致。
![]()
