氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。为探究氨气的性质,某研 究性学习小组做了以下实验:
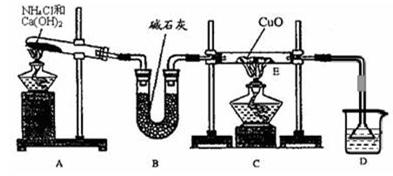
(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气。)
①实验室制取氨气的化学方程式为 。
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置B的作用是 。
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有 性。
(3)某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O。
已知:①Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+。
②在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2。
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O。(简述操作方法、现象和结论)
(4)现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。
下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀)===6Cu(NO3)2 + 2NO↑+ 7H2O】___________
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H21.12L
【答案】(1)①2NH4Cl + Ca(OH)2 === CaCl2 + 2NH3↑+ 2H2O
②吸收碳酸氢铵分解产生的CO2和水蒸气
(2)还原性
(3)取少量样品粉末于试管中,滴加稀硫酸,如果溶液呈蓝色,则样品中含有Cu2O。
(4)B
【解析】
试题分析:实验室用氯化铵和氢氧化钙固体混合加热的方式制备氨气,通过B装置,碱石灰是干燥氨气,故①的方程式为 2NH4Cl + Ca(OH)2 === CaCl2 + 2NH3↑+ 2H2O ;②若用加热碳酸氢铵固体制取纯净的氨气,B装置即是除去混合气体中的CO2气体,方程式为:NH4HCO3  NH3 ↑+CO2↑+H2O ;
NH3 ↑+CO2↑+H2O ;
(2)E装置中,黑色的氧化铜变红,说明氧化铜被还原成铜单质故氨气具有还原性;
(3)根据题意可知,Cu2O在酸溶液中发生自身氧化还原反应,生成Cu2+和Cu;故可操作为:取固体样品少许,溶解于稀硫酸溶液中,若溶液呈蓝色,证明红色固体中含有Cu2O,
(4)设Cu为xmol,Cu2O为ymol;根据3Cu—8HNO3—3Cu(NO3)2—2NO即可得n(Cu)=xmol;n(NO)=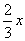 mol;3Cu2O—14HNO3—6Cu(NO3)2—2NO即可得到n(Cu2O)=ymol;n(NO)=
mol;3Cu2O—14HNO3—6Cu(NO3)2—2NO即可得到n(Cu2O)=ymol;n(NO)=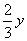 mol;由于NO共4.48L,故n(NO)=
mol;由于NO共4.48L,故n(NO)=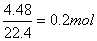 ,即
,即 ①;又因为Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。固体为CuO,根据铜原子守恒,Cu2+—CuO得到n(Cu)=n(CuO)=
①;又因为Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。固体为CuO,根据铜原子守恒,Cu2+—CuO得到n(Cu)=n(CuO)=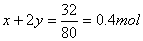 ②;两个方程形成方程组,求得x=0.2mol;y=0.1mol;n(NaOH)=2n(Cu(NO3)2)=2[x+2y]=0.8mol;V(NaOH)=
②;两个方程形成方程组,求得x=0.2mol;y=0.1mol;n(NaOH)=2n(Cu(NO3)2)=2[x+2y]=0.8mol;V(NaOH)=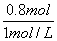 =0.8L:故A错误;经过计算m(Cu)=
=0.8L:故A错误;经过计算m(Cu)=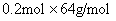 =12.8g;m(Cu2O)=
=12.8g;m(Cu2O)=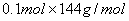 =14.4g;故Cu和Cu2O混合物质量为27.2g,B正确;Cu2O发生反应:Cu2O+H2
=14.4g;故Cu和Cu2O混合物质量为27.2g,B正确;Cu2O发生反应:Cu2O+H2 2Cu+H2O;消耗n(H2)=n(Cu2O)=0.1mol,故标况下H2体积为:
2Cu+H2O;消耗n(H2)=n(Cu2O)=0.1mol,故标况下H2体积为: ,故D错误;
,故D错误;
考点:考查物质的量计算、氮及其化合物的性质、物质的分离和提纯等相关知识点

