Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101KPa下,已知该反应每消耗1 mol CuCl2(s),放热44.4KJ,该反应的热化学方程式是 。
(4)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目 。
【答案】(1)三;ⅠA; 2;1s22s22p63s23p2 (2)<;>;<;<
(3)4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s) △H=-177.6kJ/mol (4)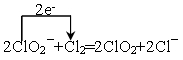
【解析】(1)Na元素的原子序数是11,位于第三周期第IA族。S元素的原子序数是16,根据核外电子排布可知,S原子的最外层有6个电子,为3s23p4,3p能级三个轨道、四个电子,依据泡利原理和洪特规则,先每个轨道排1个,方向相同,排满后再排,方向相反,故有两个孤对电子;硅的核电核数为14,根据核外电子排布规律可知,Si的基态原子核外电子排布式为1s22s22p63s23p2。

(3)该反应为氧化还原反应,Cu从+1升高到+2价,失去1个电子。O2做氧化剂,氧元素化合价从0价降低到-2价,得到2个电子,根据电子得失守恒可知,反应的化学方程式为4CuCl+O2=2CuCl2+2CuO。已知该反应每消耗1mol CuCl2(s),放热44.4KJ,则该反应的热化学方程式是4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s) △H=-177.6kJ/mol。
(4)氯气做氧化剂,氯元素化合价从0价降低到-1价,得到1个电子、亚氯酸根中氯元素的化合价从+3价升高到+4价,失去1个电子,因此根据电子得失守恒可知该反应的离子方程式可以表示为为 。
。
【考点定位】本题主要是考查物质结构、元素及化合物性质、氧化还原反应、热化学反应方程式等
【名师点晴】本题以Na、Cu、O、Si、S、Cl六种常见元素为载体,重点考查元素在周期表中的物质、核外电子排布、第一电离能、微粒半径、晶体熔点,含氧酸酸性比较等。该题难易适中,知识点覆盖全面,但题目难度不大,侧重对学生能力的考查,有利于培养学生的创新思维能力和逻辑思维能力。


